



Michał Gryz
Każde badanie kliniczne jest eksperymentem z udziałem zdrowego ochotnika, które w swoim założeniu ma zweryfikować postawioną w protokole hipotezę badawczą. Jak każdy eksperyment, badanie klinicznie związane jest z wpisanym we wszelką aktywność badawczą ryzykiem. Ryzyko to można oczywiście oszacować, wprowadzić procesy i standardy, które pozwolą na jego minimalizację, ale nie ma możliwości całkowitej jego eliminacji. Kwestia oceny ryzyka w kontekście wszelkich badań prowadzonych w udziałem ludzi została zaakcentowana w zapisach Deklaracji Helsińskiej.
16. W praktyce lekarskiej i w badaniach medycznych większości interwencji towarzyszą ryzyka i obciążenia.
Badania medyczne z udziałem ludzi mogą być prowadzone jedynie wówczas, gdy znaczenie celu badania przeważa nad nieodłącznymi ryzykami i obciążeniami dla uczestników badania.
17. Każde badanie medyczne z udziałem ludzi musi być poprzedzone staranną oceną przewidywalnych ryzyk i obciążeń dla indywidualnych osób i społeczności biorących udział w badaniu w porównaniu z możliwymi do przewidzenia korzyściami dla nich lub dla innych osób lub społeczności, których dotyczy badany problem.
Należy wdrażać działania zmierzające do minimalizowania ryzyka. Ryzyka muszą być stale monitorowane, oceniane i dokumentowane przez badacza.
Ryzyko, na jakie narażony jest pacjent oczywiście różni się w zależności od wielu czynników, takich jak faza badania, układ badania, rodzaj jednostki chorobowej, populacja pacjentów i wielu innych. Ustawodawca europejski wprowadził w ramach Rozporządzenia Parlamentu Europejskiego i Rady (UE) Nr 536/2014 z dnia 16 kwietnia 2014 r. w sprawie badań klinicznych produktów leczniczych stosowanych u ludzi oraz uchylenia dyrektywy 2001/20/WE nową definicją tzw. badania klinicznego o niskim stopniu interwencji. Rozporządzenie precyzuje jakie warunki musi spełniać badanie kliniczne, żeby spełniać tę definicję.


Magdalena Iwanowska, Adam Włodarczyk
Na początek zastrzeżenie – poniższe przemyślenia przedstawiamy w oparciu o doświadczenia własne oraz osób, z którymi współpracujemy i współpracowaliśmy w domenie badań komercyjnych (sponsorowanych przez przemysł farmaceutyczny). Tym niemniej sądzimy, że w dużej części stosować się one mogą do badań akademickich/niekomercyjnych, z tą jednak różnicą, że motywacja badaczy akademickich co do zasady jest przesunięta w stronę własnych zainteresowań naukowych czy chęci współautorstwa dobrej publikacji naukowej wynikającej z danego badania. Może mieć to – siłą rzeczy – niebagatelny wpływ na tempo rekrutacji i szeroko pojęte zaangażowanie w prowadzenie (a nierzadko i samą koncepcję/projektowanie) badania klinicznego.
Wydajność, perfekcja czy coś jeszcze?
Wybór ośrodków badawczych jest jednym z podstawowych praw i obowiązków sponsora badania (realizowanym siłami własnymi albo poprzez organizację prowadzącą badania kliniczne na zlecenie, CRO). A priori sponsorowi zależeć powinno na ośrodkach wydajnych (szybka rekrutacja pacjentów i ich przeprowadzenie przez badanie) i perfekcyjnych pod względem jakości danych klinicznych (doświadczonych w danym wskazaniu klinicznym, metodologii i logistyce badawczej, postępujących etycznie itd.). Nie jest jednak tajemnicą, że niekiedy liczą się też inne względy. W przypadku badań komercyjnych sponsor może chcieć pozyskać do roli badaczy lekarzy – liderów opinii (profesorów, prezesów towarzystw naukowych itd.) licząc, że ich zaznajomienie się z nową technologią medyczną (badanym lekiem czy wyrobem medycznym) ułatwi zaznajamianie się szerszych kręgów lekarzy (czy innych zawodów medycznych) z danym produktem w przyszłości, gdy wejdzie na rynek. A lider opinii niekoniecznie musi okazać się dobrym badaczem.
Co z „czarnymi listami” ośrodków/badaczy?


Bartłomiej Kopacz, Małgorzata Kudelska, Aneta Sitarska-Haber, Maciej Kopeć, Przemysław Grochowski
Pandemia wirusa SARS-CoV-2 dotknęła wszystkie gałęzie gospodarki, w tym branżę farmaceutyczną i obszar badań klinicznych. Z dnia na dzień znaleźliśmy się w nowej, dynamicznej sytuacji, która wymaga od nas wprowadzenia innowacyjnych rozwiązań. Firmy działające w obszarze badań klinicznych muszą również odnaleźć się wśród dodatkowych obostrzeń i restrykcji wprowadzanych przez poszczególne kraje i ośrodki badawcze. Mając na uwadze dobro i bezpieczeństwo pacjentów środowisko badań klinicznych połączyło siły, by stworzyć spójny zbiór standardów i sugerowanych rozwiązań dostosowanych do nadzwyczajnej sytuacji.
Z inicjatywy trzech organizacji branżowych: POLCRO (Polski Związek Pracodawców Firm Prowadzących Badania Kliniczne na Zlecenie), GCPpl (Stowarzyszenie na Rzecz Dobrej Praktyki Badań Klinicznych w Polsce) oraz INFARMA (Związek Pracodawców Innowacyjnych Firm Farmaceutycznych) powstał dokument: „Dobra praktyka badań klinicznych produktów leczniczych w trakcie trwania epidemii COVID-19”. Zespół projektowy prowadzony przez Bartłomieja Kopacza, i Agatę Wiesiołek został podzielony na cztery workstreamy WS (grupy robocze):
WS1 Regulacje i aspekty prawne: lider – Maciej Kopeć;
WS2 Działalność operacyjna i zarządzanie badaniami klinicznymi: liderka – Aneta Sitarska-Haber;
WS3 Badany produkt leczniczy: liderka – Małgorzata Kudelska;
WS4 Wiarygodność danych: lider – Przemysław Grochowski.
Nad początkową wersją dokumentu pracowało ponad 60 osób i zespół ten stale się powiększa obejmując już większość sponsorów i firm CRO oraz przedstawicieli ośrodków badawczych i komisji bioetycznych.
Celem zespołu projektowego było stworzenie rekomendacji i zebranie dobrych praktyk przydatnych sponsorom, firmom CRO, zespołom badawczym, ośrodkom, organom regulatorowym i komisjom bioetycznym, dla zmniejszenia zagrożeń, jakie pandemia wirusa SARS-CoV-2 może stanowić dla bezpieczeństwa uczestników badania klinicznego i wiarygodności uzyskiwanych danych. Dobra praktyka to nie tylko interpretacja lokalnych i globalnych rekomendacji, ale przede wszystkim praktyczna odpowiedź na dynamicznie zmieniające się warunki, w jakich przyszło nam prowadzić badania. To połączenie globalnego zaplecza i doświadczeń przełożonych na realia polskiego rynku, tworzone zgodnie z rekomendacjami lokalnych organów legislacyjnych.
Zespół nie poprzestał na stworzeniu Dobrych praktyk, (wersja 2.0 została opublikowana 16 kwietnia 2020, aktualnie powstaje kolejna wersja), ale równocześnie wyodrębnił propozycje, które w ramach inicjatywy INFARMA zostały wspólnie przesłane do odpowiednich organów publicznych celem rozważenia włączenia ich do rządowej Tarczy Antykryzysowej 3.0.
Janusz Kabata
W ostatnim tygodniu sierpnia 2005 roku, huragan Katrina – jeden z trzydziestu najbardziej niszczycielskich huraganów, jakie kiedykolwiek nawiedziły Stany Zjednoczone, spowodował śmierć 1836 osób, a 705 zostało uznane za zaginione. Huragan zniszczył ponad 80% Nowego Orleanu. Nie oszczędził również ośrodków badań klinicznych, gdzie poza fizycznymi stratami, spowodował przerwanie wielu toczących się w tym mieście badań klinicznych, a także utratę ponad 7 mln dolarów przychodów Health Science Center Uniwersytetu Stanowego w Luizjanie. Po huraganie wielu badaczy opuściło Nowy Orlean, co dodatkowo utrudniło odtworzenie badań klinicznych w tym mieście. Przypadek huraganu Katrina pokazał skalę nieprzygotowania się środowiska naukowego na wypadek tego typu katastrof. Często cytowana 15 lat temu w mediach amerykańskich wypowiedź Dr Cory Christian: Drug Development and hurricanes have much in common…what takes years to build can be destroyed in a moment (DIA Annual Meeting, June 2005) wydaje się być jak nigdy dotąd aktualna.
Katrina dostarczyła trzech ważnych lekcji, które nieodwracalnie zmieniły badania kliniczne:
Wynikiem Katriny są powszechnie stosowane w badaniach klinicznych Standardowe Procedury Operacyjne najczęściej tytułowane jako „Disaster Recovery Plan”, a po zagrożeniach związanych z ptasią grypą dodatkowo również „Pandemic Preparedness SOP”.
Skala pandemii COVID-19 jest nieporównywalna do doświadczeń huraganu, którego lokalne oddziaływanie miało tak duży wpływ na prowadzenie badań klinicznych. Pandemia, która w kilka tygodni ogarnęła świat, do połowy czerwca 2020 doprowadziła do śmierci ponad 470 tysięcy ludzi w 187 krajach. W jej wyniku najbardziej ucierpiały Stany Zjednoczone oraz wysokorozwinięte kraje Europy Zachodniej o najwyższych poziomach jakości usług medycznych. Odnosi się wrażenie, że kraje, w których dostępne są najbardziej wyrafinowane procedury medyczne, nie radzą sobie ze zdrowiem publicznym.
Pandemia w bardzo krótkim czasie wywołała olbrzymie zmiany społeczne, ekonomiczne i wpłynęła na sposób funkcjonowania służby zdrowia. Zjawisko dystansowania społecznego zaskoczyło nas wszystkich. Nikt z nas nie spodziewał się, że kontakty międzyludzkie zostaną zastąpione wirtualizacją życia do tego stopnia, że codziennie gościmy w domach polityków, lekarzy, artystów oraz naszych bliskich. Przestaliśmy podróżować, robić zakupy, a nawet chorować, odkładając problemy zdrowotne nie związane z koronawirusem na później. Okazuje się, że aby uczestniczyć w konferencji naukowej nie trzeba jechać na drugi koniec świata. Mało tego, w takim wydarzeniu może uczestniczyć każdy, niezależnie od jego pozycji w firmie, czy też możliwości finansowania udziału w kosztownych kongresach.
Tak gwałtowne zmiany nie mogą nie odbić się na sposobie funkcjonowania badań klinicznych.
Aby wyobrazić sobie zmiany jakie zajdą w naszym przemyśle, warto zastanowić się nad tym co było, co jest, i jak mogą wyglądać badania kliniczne w przyszłości.


Rozmawiał: Dariusz Olszewski,
Redaktor Naczelny, Badania Kliniczne
Panie Profesorze, dlaczego zajmuje się Pan badaniami klinicznymi?
Z dwóch głównych powodów. Najważniejsza jest oczywiście ciekawość naukowa. Ta pasja badawcza towarzyszy mi od początku mojej działalności jako lekarza i akademika. Poza tym, spośród wszystkich form działalności naukowej w medycynie, badania kliniczne mają najbardziej praktyczne i bezpośrednie przełożenie do kliniki. Dla mnie, jako klinicysty, jest to bardzo silna motywacja.
Kiedy badania kliniczne stały się codziennym elementem Pana pracy?
Jako młody człowiek spędzałem dużo czasu w laboratorium, gdzie mogłem się wyżywać naukowo. Moje pierwsze badanie kliniczne sam zaplanowałem, zorganizowałem i zrealizowałem krótko po skończeniu studiów w 1975 roku. Dotyczyło ono immunoterapii czerniaka złośliwego i było podstawą doktoratu, który obroniłem już cztery lata później. Stanowiłem jednoosobowy zespół badawczy, a potem sam przeprowadziłem analizę statystyczną, opracowałem i zinterpretowałem wyniki. Realizację dużych wieloośrodkowych badań klinicznych rozpocząłem w 1981 roku. Były to badania typowo akademickie, bez sponsorów z przemysłu farmaceutycznego, w których trzeba było wszystko samodzielnie zorganizować, napisać protokół, stworzyć CRF i wyszukać entuzjastów, którzy bez żadnego wynagrodzenia chcieli w nich uczestniczyć. Temat realizowanych badań miał ogólny tytuł „Opracowanie wskazań do niechirurgicznego leczenia raka płuca w zależności od jego budowy histologicznej i stopnia zaawansowania”. Badania, które wtedy realizowaliśmy dotyczyły głównie drobnokomórkowego raka płuca i wzięło w nich udział około 700 chorych z 10 polskich ośrodków. Było to duże wyzwanie, ale wszystko zakończyło się sukcesem, a wyniki naszych badań opublikowaliśmy w renomowanych zagranicznych czasopismach. Myślę, że w ten sposób wnieśliśmy pewien wkład do rozwoju leczenia tego nowotworu. Badania te stały się również podstawą mojej habilitacji w 1986 roku.
To bardzo ciekawe. Prawdopodobnie wielu czytelników może nie wiedzieć, że już wtedy w Polsce realizowano tak ambitne badania akademickie. Jakie funkcje wtedy Pan pełnił? Czym się Pan zajmował?
Ukończyłem studia w 1975 roku, więc łatwo policzyć jakie miałem doświadczenie rozpoczynając te badania. Realizowaliśmy je jako jedno z zadań Programu Rządowego nr 6, a następnie w ramach Centralnych Programów Badawczo-Rozwojowych. Jeden z tych projektów dotyczył onkologii i był finansowany centralnie. Co roku otrzymywaliśmy dotację, którą musieliśmy rozliczyć i złożyć merytoryczne sprawozdanie. Krajowym kierownikiem tych badań była moja starsza koleżanka, Dr Hanna Karnicka-Młodkowska, a ja, oprócz zadań badacza, byłem jej zastępcą. Większość prac związanych z koordynacją musieliśmy wykonać sami, bo w tamtych czasach nie było całego zaplecza w postaci CRO, monitorów czy lokalnych koordynatorów. Kwestionariusze były oczywiście w formie drukowanej, w związku z tym przed wprowadzeniem danych do elektronicznej bazy musieliśmy je ręcznie sprawdzać i czasem porównać ze źródłowymi danymi. Później stworzyliśmy dodatkowy program komputerowy, który pozwalał wykrywać np. wewnętrzne sprzeczności w kwestionariuszach, co trochę przyspieszyło pracę. To była zupełnie pionierska i bardzo chałupnicza praca. Dane spływały z całej Polski i dotyczyły kilkuset chorych, każdy z nich miał kilkanaście kwestionariuszy, więc spędzaliśmy nad nimi przez kilka lat po 20-30 godzin miesięcznie. Oczywiście robiliśmy to wieczorami i w niedziele (nie było jeszcze wolnych sobót), bo w pracy nie było na to czasu. W Gdańsku były wtedy dwa komputery, które spełniały nasze wymagania. Obydwa znajdowały się w Instytucie Maszyn Przepływowych PAN. Głównym był komputer RIAD wielkości połowy tramwaju, a drugim polski komputer Odra ileś tam, do którego dane były wprowadzane przy użyciu kart brzeżnie perforowanych. Wspominam te czasy z dużym sentymentem. Oczywiście musieliśmy poszukać człowieka, który przeprowadzi analizę statystyczną. Na szczęście studiowałem na roku z Piotrem Mierzewskim, późniejszym wiceministrem zdrowia w rządzie Tadeusza Mazowieckiego, który miał odpowiednie kwalifikacje i się tego podjął. Mieliśmy dużo szczęścia, bo w tamtych czasach nie było profesjonalnych biostatystyków, którzy rozumieli dane kliniczne, potrafili je zanalizować i zinterpretować. Niezależnie od tego przegadaliśmy z Piotrem niejedną noc, aby wyjaśnić wszystkie zawiłości projektu i zinterpretować wyniki. Przy okazji nauczyłem się sporo statystyki, co do dziś ogromnie ułatwia mi interpretację doniesień naukowych czy planowanie własnych badań. Wielu klinicystów nie rozumie na przykład, że przed rozpoczęciem eksperymentu medycznego trzeba oszacować liczbę przypadków czy zdarzeń koniecznych do zweryfikowania hipotezy. Jeśli robi się to intuicyjnie, można zmarnować cały wysiłek badawczy.
Czego dotyczyły te badania?
W tamtym czasie w drobnokomórkowym raku płuca stosowano kilka schematów chemioterapii, przy czym nie było wiadomo, który z nich jest najbardziej skuteczny. Podjęliśmy więc próbę ich porównania. Opracowaliśmy również i ocenialiśmy własny, w pełni oryginalny schemat chemioterapii. Drugim nurtem badań była ocena skuteczności paliatywnej radioterapii chorych na raka płuca. Publikacje będące plonem tych badań można znaleźć w bazie PubMed.
A kiedy pojawiły się propozycje współpracy spoza Polski?
W 1984 roku. Wtedy, jako jeden z pierwszych ośrodków z Europy Środkowo-Wschodniej, podjęliśmy współpracę z Europejską Organizacją do Badań nad Leczeniem Raka (EORTC), najpierw z Grupą Raka Piersi, a krótko potem z Grupą Raka Płuca. Później pełniłem w tej organizacji wiele zaszczytnych funkcji , m.in. przewodniczącego Grupy Raka Piersi i członka Zarządu. Obecnie jestem członkiem Scientific Advisory Committee, którego zadaniem jest ocena działalności naukowej poszczególnych grup narządowych. Z EORTC nadal ściśle współpracujemy i, z uwagi na wysoką wartość naukową tych badań, traktujemy je priorytetowo. Komercyjne badania kliniczne zaczęliśmy realizować na początku lat 90. i obecnie stanowią one większość, choć staramy się zachować pewną proporcję w stosunku do badań akademickich.
Jakie inicjatywy i organizacje międzynarodowe warto jeszcze wymienić, kiedy mowa o współpracy w badaniach nad leczeniem chorób nowotworowych?
Drugą, oprócz wspomnianej EORTC, międzynarodową organizacją, gdzie realizujemy badania kliniczne jest Central and East European Oncology Group (CEEOG, wcześniej SEEOG). Powstała ona w 1983 roku, jako agenda Rady Wzajemnej Pomocy Gospodarczej (RWPG), zrzeszającej państwa ówczesnego Bloku Wschodniego. Jej siedziba mieściła się wówczas w Budapeszcie. Wraz z kilkoma badaczami z Polski, m.in. prof. Pawlickim, doktorami Zborzilem, Siedleckim, Madejem i Krzakowskim, jeździliśmy tam regularnie na spotkania badaczy, mniej więcej dwa razy w roku. Plonem tych badań było sporo międzynarodowych publikacji, co w czasach żelaznej kurtyny było sporym osiągnięciem. W 1999 roku szef CEEOG, Prof. Sandor Eckhardt, przekazał mi prowadzenie Grupy i funkcję tę pełnię do dzisiaj. Obecnie CEEOG zrzesza około 35 instytucji; jesteśmy także członkiem Breast International Group (BIG), konsorcjum zrzeszającego organizacje prowadzące badania nad rakiem piersi. W 2005 roku powołaliśmy w CEEOG grupę roboczą prowadzącą badania nad przerzutami do mózgu, która współpracuje z amerykańską Brain Working Group. Klinika uczestniczy również w badaniach realizowanych przez inne międzynarodowe grupy akademickie z Europy i USA.
A czy może Pan wymienić ważniejsze badania kliniczne zainicjowane przez polskich badaczy?
Niestety jest ich w onkologii niewiele. Wynika to głównie z braku możliwości ich finansowania. Na przykład uzyskanie środków z NCBiR jest prawie niemożliwe, ponieważ instytucja ta finansuje inny rodzaj projektów. Jeżeli we wniosku pojawiał się element pod tytułem „badanie kliniczne”, to od razu słyszeliśmy, że to nie jest ich obszar finansowania. Od czasu do czasu udaje się jednak zrealizować jakieś badanie. Możemy się np. pochwalić badaniem klinicznym III fazy, które zaplanowaliśmy w Gdańsku i zrealizowaliśmy przy współpracy kilku polskich ośrodków. Porównywało ono dwa sposoby frakcjonowania radioterapii u chorych na zaawansowanego niedrobnokomórkowego raka płuca. Opublikowaliśmy je w 2005 roku w „British Journal of Cancer”, było wielokrotnie cytowane i miało wpływ na praktykę kliniczną. Zrealizowaliśmy także kilka jednoośrodkowych badań klinicznych w dziedzinie radioterapii i leczenia systemowego; wszystkie zostały opublikowane w dobrych czasopismach.
Największe osiągnięcia w Polsce ma tutaj Prof. Krzysztof Bujko, który zrealizował kilka wieloośrodkowych badań klinicznych dotyczących raka odbytnicy. Są one bardzo dobrze znane na świecie. Krzysztof stał się uznanym międzynarodowym autorytetem, a my jesteśmy dumni, że nawet w polskich trudnych warunkach można zrealizować ważne, wieloośrodkowe badania zmieniające praktykę kliniczną. Chciałbym także wymienić Prof. Piotra Rutkowskiego, który nie tylko inicjuje akademickie badania kliniczne, ale także zabiega o poprawę możliwości ich realizacji w Polsce. Wśród badań, które oddolnie podejmowaliśmy i realizowaliśmy z sukcesami, są także akademickie badania realizowane we współpracy z przemysłem farmaceutycznym (tzw. investigator initiated studies). Wiele firm ma środki na takie badania i jeśli pojawia się dobry pomysł, można uzyskać na nie grant. Badacze w tej formule mają dużą niezależność, muszą się jedynie rozliczyć z firmą, wykonując zaplanowane badanie. W takich badaniach dobrze współpracowało się nam np. z firmą GSK, której dział onkologiczny przeszedł później do Novartis, czy z firmą Roche.
Czy Agencja Badań Medycznych, która obecnie ma wspierać rozwój badań akademickich, jest więc potrzebna?
Postulat finansowania badań z publicznych środków wysuwaliśmy od wielu lat. Patrzyliśmy z zazdrością na zagraniczne ośrodki, które realizowały takie badania, także poza międzynarodowymi organizacjami takimi jak EORTC. Wielokrotnie podnosiliśmy tę kwestię; wystarczy choćby zajrzeć do „Strategii walki z rakiem w Polsce 2015-2024” http://www.walkazrakiem.pl/, która powstała pod moim kierunkiem. Osobą, która ma bardzo duże zasługi w lobbowaniu na rzecz tych badań jest Prof. Piotr Rutkowski. Ja także uczestniczyłem w tych działaniach, wspierając je np. w Parlamencie, Ministerstwie Zdrowia czy Ministerstwie Nauki. Powstanie Agencji Badań Medycznych przyjąłem zatem z radością i nadzieją. Ta instytucja na początku swojego rozwoju trochę burzliwie się rozwijała, ale pierwszy konkurs został rozstrzygnięty i projekty są realizowane. Konkurs wzbudził spore zainteresowanie, a finansowanie otrzymało 28 spośród 78 zgłoszonych, więc konkurencja była duża.
Co Pan sądzi na temat projektów zgłoszonych do pierwszego konkursu organizowanego przez ABM w obszarze onkologii?
Kryteria dla projektów onkologicznych w pierwszym konkursie były dosyć wąskie. Głównie dlatego, że obejmowały one testowanie w nowych wskazaniach czy sposobach dawkowania substancji, które były już wcześniej zarejestrowane. Takie projekty mogą być finansowane przez przemysł farmaceutyczny w ramach investigator initiated studies. Myślę, że z tego powodu wielu wartościowych pomysłów nie udało się w te ramy włożyć – ostatecznie finansowanie otrzymało tylko 8 projektów w dziedzinie onkologii. Liczę, że z czasem konkursy będą dawały możliwość szerszych badań w tej dziedzinie. Oby tylko w Agencji przybywało środków finansowych, bo duże badania kliniczne wymagają znacznie większych nakładów.
Niedawno skończył się kongres Amerykańskiego Towarzystwa Onkologii Klinicznej (ASCO). Czy jakieś badanie zwróciło Pańską szczególną uwagę?
Zajmuję się głównie rakiem płuca i rakiem piersi, i tu staram się śledzić wszystko na bieżąco. Taktykę leczenia chorych na niedrobnokomórkowego raka płuca z mutacją EGFR może zmienić badanie ADAURA. Chorzy po leczeniu operacyjnym, niezależnie od ew. chemioterapii, otrzymywali ozymertynib (inhibitor EGFR trzeciej generacji) lub placebo. Wyniki okazały się zaskakująco dobre. Rzadko się zdarza, żeby w badaniu klinicznym współczynnik ryzyka nawrotu wynosił 0,17. Jako ciekawostkę dodam, że jakiś czas temu recenzowałem dla czasopisma „Lancet Respiratory Medicine”, a następnie pisałem tam komentarz redakcyjny do podobnego badania klinicznego chińskich autorów, przy czym stosowano w nim erlotynib. Stwierdziłem wówczas, że wyniki są obiecujące, ale z wnioskami dla praktyki klinicznej należy się wstrzymać do czasu ukończenia badania ADAURA. Cieszę się, że przyniosło ono tak dobry wynik, bo to wytycza nowe kierunki. Sukces tego badania jest także wynikiem dobrze skonstruowanego protokołu i jego wzorowej realizacji. Z drugiej strony musimy cierpliwie zaczekać na dane dotyczące całkowitego przeżycia, bo one mają największą wagę.
W grupie badań na temat raka piersi moje zainteresowanie zwróciły dwa doniesienia pokazujące możliwości tzw. „deeskalacji” leczenia systemowego. Pierwsze, to późne wyniki badania MINDACT. Potwierdzają one, że na podstawie oceny genomowego ryzyka nawrotu można uniknąć pooperacyjnej chemioterapii u dużej części chorych na wczesnego luminalnego raka piersi. Drugie, to badanie TRAIN-2, które pokazuje, że w przedoperacyjnej chemioterapii chorych na HER2-dodatniego raka piersi względnie toksyczne schematy oparte na antracyklinach można zastąpić mniej agresywnym leczeniem niezawierającym tych substancji.
Istotne znaczenie kliniczne ma również badanie pokazujące wydłużenie mediany czasu przeżycia o rok pod wpływem leczenia olaparybem (inhibitor PARP) u chorych po nawrocie raka jajnika z mutacją BRCA1 lub BRCA2. To badanie zmienia filozofię leczenia tego nowotworu, bowiem po raz pierwszy uwzględnia jego cechy molekularne. Przypomina to sytuację w raku piersi, gdzie od lat dobiera się leczenie systemowe – chemioterapię, hormonoterapię czy leki anty-HER2 – w zależności od fenotypu nowotworu.
Czego nauczyła nas pandemia wywołana koronawirusem? Czy Pana zdaniem wstrzymanie rekrutacji w niektórych badaniach było dobrą decyzją? Jak to wygląda z perspektywy kliniki?
Warto sprawdzić jaki był odsetek wstrzymanych badań klinicznych w onkologii w porównaniu do innych dziedzin medycyny. Obecnie w naszej klinice prowadzimy ponad 20 badań. W kilku, decyzją sponsorów, wstrzymano rekrutację, inne rozpoczęto z opóźnieniem. Jest to zrozumiałe, bowiem w sytuacji pandemii sponsor może się czuć współodpowiedzialny za ew. narażenie chorego na zakażenie. Dodatkowym argumentem jest to, że w takich warunkach trudno jest w pełni zrealizować wymogi protokołu, co może utrudnić interpretację wyników. Badania kliniczne w onkologii stwarzają jednak wielu chorym szansę na przedłużenie przeżycia, zwłaszcza jeśli wyczerpały się inne metody leczenia. Myślę, że ze względów etycznych takich badań nie powinno się przerywać w czasie pandemii.
Ten okres był dla nas nowym doświadczeniem, bowiem musieliśmy ważyć korzyści dla chorych oraz ryzyko związane z możliwością zakażenia. W szpitalu wprowadzono szereg restrykcji, które dotyczyły także prowadzenia badań klinicznych. Koordynatorki, podobnie jak wszyscy inni pracownicy, przeszli kilkukrotne obowiązkowe szkolenia online. W najtrudniejszym momencie, z uwagi na możliwość zbiorowego zakażenia, musieliśmy wprowadzić pracę zmianową, dzieląc zarówno koordynatorki, jak i pielęgniarki, na niestykające się ze sobą grupy. Było to sporym wyzwaniem, zwłaszcza, że przejęliśmy sporo chorych ze szpitali jednoimiennych. Zawieszono wizyty monitorów, którzy wcześniej odwiedzali nas niemal codziennie, wprowadzając w zamian na dużą skalę zdalne monitorowanie. Obecnie monitorzy pojawili się ponownie w szpitalu, ale muszą mieć aktualny ujemny wynik testu na COVID-19. Pozostali spotykają się z badaczami w specjalnym pomieszczeniu zapewniającym pełną izolację. Wydłużyliśmy także do godziny 21.00 czas, w którym monitorzy mogą przebywać w szpitalu, co pozwala zmniejszyć częstość ich wizyt. Tam gdzie było to możliwe, odraczaliśmy wizyty kontrolne chorych lub zastępowaliśmy je teleporadami. Za zgodą uczelnianej Komisji Etycznej chorym otrzymującym leki doustne w warunkach domowych wydawaliśmy je na dwa cykle lub wysyłaliśmy kurierem. W przypadku chorych, którzy musieli zgłosić się do szpitala na podanie leku lub na wizytę kontrolną, zbieraliśmy w przeddzień telefonicznie wywiad epidemiologiczny, a w dniu wizyty przeprowadzaliśmy rutynowy triaż. Chorzy, którzy wymagali hospitalizacji, musieli w dniu przyjęcia obowiązkowo przejść badanie na obecność COVID-19. Staraliśmy się także zapewnić chorym bezpieczny transport, proponując przejazdy taksówkami zamiast środkami komunikacji miejskiej. Mam wrażenie, że docenili oni nasz wysiłek, ponieważ bardzo niewielu zrezygnowało z udziału w badaniu klinicznym w obawie o zakażenie.
Domyślam się, że otrzymują Państwo wiele propozycji badań. Jakie są kryteria wyboru tych, które będą realizowane w klinice?
Istotnie, propozycji badań jest znacznie więcej niż możliwości ich realizacji. Wstępnej selekcji badań dokonuję osobiście i te, które są do rozważenia, konsultuję z Zespołem. Moi współpracownicy podzieleni są na kilka grup narządowych i w zależności od rodzaju nowotworu, kieruję zapytanie do odpowiedniej. Odrzucamy około 2/3 propozycji. Kierujemy się przy tym kilkoma kryteriami. Pierwszym są względy etyczne – jeśli mamy tutaj jakiekolwiek wątpliwości, rezygnujemy z badania. Po drugie, sprawdzamy, czy mamy wystarczającą liczbę chorych spełniających kryteria protokołu. Po trzecie, bierzemy pod uwagę, czy badanie wypełnia tzw. niszę terapeutyczną, tj. stwarza chorym możliwość leczenia w sytuacji, kiedy nie mamy im nic innego do zaoferowania. Oceniamy także naukową wartość badania. Jesteśmy ośrodkiem akademickim, więc staramy się wybierać te z nich, które stwarzają istotną szansę na postęp. Jeśli zatem mamy do wyboru badanie zupełnie nowej substancji lub badanie, które służy wyłącznie uzyskaniu rejestracji odpowiednika znanego leku, wybór jest prosty. Prawie nigdy nie przyjmujemy do realizacji badań, które stanowią konkurencję dla obecnie planowanych lub już zakontraktowanych. Obowiązuje nas bowiem pewna uczciwość wobec sponsorów – jeśli deklarujemy udział w jakimś badaniu z odpowiednią liczbą włączonych chorych, trudno ich potem rozdzielać na kilka badań.
Zmieńmy nieco temat. Jest Pan autorem książki „Zatrzymane w biegu”, która stanowi zapis Pana walki z chorobą nowotworową. Nieczęsto się zdarza, aby lekarz-naukowiec był pacjentem.
Nie sądzę, żeby lekarze czy naukowcy chorowali na nowotwory rzadziej niż inni ludzie. To, że jest mało takich sytuacji wynika tylko z tego, że stanowimy niewielki ułamek społeczeństwa. Poza tym nie wszyscy pacjenci, także lekarze, przyznają się do chorób nowotworowych. Zawsze reprezentowałem stanowisko, że choroba nowotworowa nie jest żadnym wstydem i teraz mogłem dać temu osobiste świadectwo. O swojej chorobie od razu poinformowałem współpracowników, przyjaciół i znajomych. Ponieważ sprawa stała się szeroko znana, wiele osób pytało mnie o przebieg choroby i samopoczucie. Po jakimś czasie nie nadążałem już z odpowiadaniem, tym bardziej że zdawkowe odpowiedzi nie wszystkim wystarczały. Pomyślałem więc, że może warto spisywać swoje doświadczenia w formie dziennika i przesyłać jego fragmenty zainteresowanym osobom. Później, kiedy już wychodziłem z choroby, kilka mediów poprosiło mnie o wywiad. Wielu pacjentów, w tym zupełnie mi nieznanych, podkreślało, że moja postawa pomogła im znieść trudy choroby, bo trochę ją odczarowuję i „oswajam”. Wielu czytelników dziennika namawiało mnie także, aby go opublikować. Długi czas nie byłem do tego przekonany, ale ostatecznie, biorąc także pod uwagę pozytywny odbiór moich wypowiedzi w mediach, zgodziłem się na ten pomysł. Przygotowanie tego w formie książki kosztowało mnie trochę pracy – pewne fragmenty musiałem przeredagować, wyszukać w rodzinnym archiwum zdjęcia, dokładnie sprawdzić faktografię itp. Przedsięwzięcie wsparła finansowo grupa znajomych z Gdańska, co przyspieszyło wydanie książki.
Co zmieniło to doświadczenie?
Zobaczyłem ten problem jak Alicja w Krainie Czarów – z drugiej strony lustra. Nie jestem już tylko tym, który się „mądrzy” i mówi chorym, jakie jest najlepsze leczenie, że mają mu się poddać i dzielnie znieść jego trudy. Mogę teraz własnym przykładem zaświadczyć, że da się przeżyć nawet bardzo agresywne leczenie. To, że żyję i normalnie funkcjonuję po tak ciężkiej chorobie pokazuje również, że trzeba ją traktować jedynie jako pewien epizod życiowy. Jest to ważne wydarzenie, często punkt zwrotny w życiu, ale nie powinno zdominować wszystkich pozostałych spraw. Każda choroba kiedyś się bowiem zaczyna, i kiedyś kończy. Jeśli kończy się dobrze, trzeba przestać się nią zadręczać i zacząć żyć normalnie. Jako onkolog przeżywałem swoją chorobę bardziej świadomie niż przeciętny pacjent. Nie musiałem się o wszystko dopytywać, bo większość spraw była dla mnie oczywista. Ważne było również przekonanie, że otrzymuję leczenie oparte na dowodach naukowych, że ktoś kiedyś zrobił badania kliniczne, które udowodniły jego wartość. Poza tym miałem ogromne zaufanie do leczących mnie lekarzy, co dla każdego pacjenta ma kapitalne znaczenie.
Czy był Pan w tym czasie uczestnikiem badania klinicznego?
Nie, otrzymywałem standardowe leczenie, takie jak każdy chory w Polsce i na świecie, bo w moim przypadku było to akurat leczenie powszechnie przyjęte.
Teoretycznie więc zapytam: czy gdyby wtedy wiedział Pan o jakimś badaniu, to zdecydowałby się Pan wziąć w nim udział?
Jestem przekonany, że badania kliniczne są korzyścią nie tylko dla przyszłych chorych, ale również dla ich uczestników. Otrzymują oni bowiem najlepsze możliwe leczenie lub takie, które stwarza szanse na postęp. We współczesnych badaniach klinicznych ryzyko dla uczestnika jest naprawdę niewielkie, a nasz ośrodek hematologiczny należy do najlepszych w Polsce. Z tego powodu zrezygnowałem zresztą z propozycji leczenia za granicą, bo miałem pełne przekonanie, że w Gdańsku będzie ono równie dobre. Gdyby więc pojawiła się propozycja leczenia w ramach badania klinicznego, bez wahania bym ją przyjął.
Panie Profesorze, bardzo dziękuję. Życzę jak najwięcej zdrowia i realizacji wszystkich planów przez Pana Profesora i Pański Zespół.
 Profesor zwyczajny Gdańskiego Uniwersytetu Medycznego, kierownik Katedry i Kliniki Onkologii i Radioterapii (od 1990), specjalista w dziedzinie radioterapii i onkologii klinicznej. Stopień doktora nauk medycznych uzyskał w 1980 roku, doktora habilitowanego w 1986 roku, a tytuł profesora w 1995 roku. Przebywał na stażach naukowych za granicą: w Szpitalu Karolinska w Sztokholmie (1997) oraz w Narodowym Instytucie Onkologii w Amsterdamie (1989/1990 i 1994). Jego główne zainteresowania naukowe to onkologia kliniczna, szczególnie rak płuca, rak piersi, skojarzone leczenie nowotworów i onkologia molekularna. Jest współautorem ponad 800 pełnotekstowych publikacji, podręczników i rozdziałów w podręcznikach polskich i zagranicznych, a także 11 patentów i wniosków patentowych. Skumulowany impact factor jego publikacji wynosi 2054. Jest jednym z najczęściej cytowanych w świecie polskich lekarzy (ponad 22 000 cytowań w bazie Web of Science, h-indeks 59; czerwiec 2020). Otrzymał wiele krajowych i zagranicznych nagród naukowych, w tym nagrodę Prezesa Rady Ministrów, nagrodę Prezydenta Miasta Wiednia, nagrodę im. Sobolewskich Polskiego Towarzystwa Onkologicznego i nagrodę im. Jana Heweliusza Prezydenta Miasta Gdańska. Jest jednym z dwóch polskich członków European Academy of Cancer Sciences, członkiem Academia Europea i członkiem-korespondentem Polskiej Akademii Umiejętności. Był członkiem komitetów redakcyjnych wielu prestiżowych czasopism naukowych, w tym „Lancet Oncology”, „European Journal of Cancer”, „Cancer Treatment Reviews”, „Radiotherapy and Oncology” i „Journal of Thoracic Oncology”.
Profesor zwyczajny Gdańskiego Uniwersytetu Medycznego, kierownik Katedry i Kliniki Onkologii i Radioterapii (od 1990), specjalista w dziedzinie radioterapii i onkologii klinicznej. Stopień doktora nauk medycznych uzyskał w 1980 roku, doktora habilitowanego w 1986 roku, a tytuł profesora w 1995 roku. Przebywał na stażach naukowych za granicą: w Szpitalu Karolinska w Sztokholmie (1997) oraz w Narodowym Instytucie Onkologii w Amsterdamie (1989/1990 i 1994). Jego główne zainteresowania naukowe to onkologia kliniczna, szczególnie rak płuca, rak piersi, skojarzone leczenie nowotworów i onkologia molekularna. Jest współautorem ponad 800 pełnotekstowych publikacji, podręczników i rozdziałów w podręcznikach polskich i zagranicznych, a także 11 patentów i wniosków patentowych. Skumulowany impact factor jego publikacji wynosi 2054. Jest jednym z najczęściej cytowanych w świecie polskich lekarzy (ponad 22 000 cytowań w bazie Web of Science, h-indeks 59; czerwiec 2020). Otrzymał wiele krajowych i zagranicznych nagród naukowych, w tym nagrodę Prezesa Rady Ministrów, nagrodę Prezydenta Miasta Wiednia, nagrodę im. Sobolewskich Polskiego Towarzystwa Onkologicznego i nagrodę im. Jana Heweliusza Prezydenta Miasta Gdańska. Jest jednym z dwóch polskich członków European Academy of Cancer Sciences, członkiem Academia Europea i członkiem-korespondentem Polskiej Akademii Umiejętności. Był członkiem komitetów redakcyjnych wielu prestiżowych czasopism naukowych, w tym „Lancet Oncology”, „European Journal of Cancer”, „Cancer Treatment Reviews”, „Radiotherapy and Oncology” i „Journal of Thoracic Oncology”.
Był przewodniczącym Zarządu Głównego Polskiego Towarzystwa Onkologicznego, członkiem Zarządu Europejskiej Organizacji do Badań nad Rakiem (EORTC), przewodniczącym Grupy Raka Piersi EORTC, przewodniczącym Komitetu Spraw Zagranicznych Amerykańskiego Towarzystwa Onkologii Klinicznej oraz członkiem zarządów Europejskiego Towarzystwa Radioterapii Onkologicznej i Europejskiego Towarzystwa Onkologii Klinicznej. Jest przewodniczącym Środkowoeuropejskiej Grupy Onkologicznej (CEEOG) oraz prezesem Polskiej Ligi Walki z Rakiem. Prowadzi działalność w zakresie zdrowia publicznego, m.in. opracował projekt ustawy zakazującej palenia tytoniu w miejscach publicznych (wprowadzonej w 2010 roku) oraz koordynował opracowanie „Strategii Walki z Rakiem w Polsce 2015-2024”. Za swoją działalność społeczną otrzymał nagrodę im. Josepha Cullena Międzynarodowego Towarzystwa do Badań nad Rakiem Płuca, tytuł „Wybitny Polak” Fundacji „Teraz Polska”, tytuł Menadżera Roku w Ochronie Zdrowia i nagrodę Złotego Otisa.
Otwarcie mówi o swojej chorobie nowotworowej, którą przeszedł w 2018 roku; swoje przeżycia opisał w książce „Zatrzymane w biegu”.


Rozmawiał: Dariusz Olszewski,
Redaktor Naczelny, Badania Kliniczne
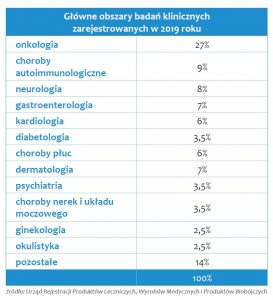
W zeszłym roku informowałem, że rezygnacja z konieczności składania wraz z wnioskiem o rozpoczęcie badania klinicznego umów zawieranych pomiędzy sponsorem a badaczem i ośrodkiem badawczym wpłynęła korzystnie na liczbę wpływających wniosków. W tym roku mogę potwierdzić, że nie była to chwilowa tendencja – w 2019 roku otrzymaliśmy niewiele mniej wniosków niż w 2018 roku (jak dotąd rekordowym). Do Centralnej Ewidencji Badań Klinicznych wpisaliśmy aż 603 badania – to nowy rekord zarejestrowanych w danym roku badań. Jak co roku największa liczba wniosków o rozpoczęcie badania klinicznego dotyczyła onkologii – 27% wniosków. Inne obszary medycyny, dla których w 2019 otrzymaliśmy najwięcej wniosków o rozpoczęcie badania klinicznego to choroby autoimmunologiczne (9%), neurologia (ponad 8%), gastroenterologia (7%), dermatologia (7), kardiologia (6%) i choroby płuc (6%). W 2019 roku wzrosła do 9% liczba badań prowadzonych z udziałem populacji pediatrycznej (w 2018 roku było to 6,5% badań, w 2017 roku – 5%). Onkologia, choroby autoimmunologiczne i neurologia – tych obszarów dotyczyła największa liczba badań klinicznych rejestrowanych w ostatnich latach.
W odniesieniu do faz zgłaszanych do Urzędu badań, jak co roku najwięcej wniosków o rozpoczęcie badania klinicznego dotyczyło fazy III – 52% i II – 32%. Zaobserwowaliśmy wzrost liczby badań zgłaszanych jako faza I – w 2019 roku aż 12% wniosków złożonych stanowiły badania I fazy. Około 4% stanowiły badania porejestracyjne 4 fazy.
Trudno mi powiedzieć czy widoczne są różnice w badaniach prowadzonych i rejestrowanych w poszczególnych krajach europejskich, nie prowadzimy takich analiz. Z całą pewnością w wielu krajach europejskich rejestruje się znacznie więcej badań niekomercyjnych.
Temat badań niekomercyjnych w Polsce był szeroko omawiany w zeszłym roku w związku z powstaniem Agencji Badań Medycznych. Mamy nadzieję, że dzięki finansowaniu ABM liczba badań prowadzonych przez sponsorów niekomercyjnych znacznie wzrośnie w najbliższych latach. Jeżeli chodzi o liczbę wniosków o rozpoczęcie badania klinicznego składanych w poszczególnych krajach Unii Europejskiej to, biorąc pod uwagę dane z europejskiej bazy badań klinicznych EudraCT, Polska plasuje się 6 miejscu: po Hiszpanii, Niemczech, Wielkiej Brytanii, Francji i Holandii.
Liczba pacjentów zadeklarowana we wnioskach o rozpoczęcie badania klinicznego złożonych w 2019 roku to ponad 30 000 osób.
Im więcej badań rejestrujemy tym więcej badań się toczy. W zeszłym roku w Centralnej Ewidencji Badań Klinicznych było ponad 2000 niezakończonych badań klinicznych.
Rocznie otrzymujemy kilkanaście wniosków o rozpoczęcie badania klinicznego sponsorowanych przez polskie firmy – w dużej mierze wnioski te dotyczą biorównoważności; wnioski dotyczące innowacyjnych rozwiązań, nowych cząsteczek zdarzają się rzadko – w ostatnich latach pojawiają się częściej – nadal są to jednak pojedyncze przypadki. Nie są to zaskakujące dane – od lat mówi się w Polsce o konieczności wzmacniania i rozwoju potencjału naukowego oraz potencjału krajowego sektora farmaceutycznego tak, aby to Polska była źródłem innowacyjnych leków.
Niestety nie zaobserwowaliśmy wzrostu liczby wniosków sponsorów niekomercyjnych. Najwyższa liczba takich wniosków – 24 – wpłynęła do Urzędu w 2017 roku. W 2018 roku było to 18 wniosków, a w 2019 – tylko 16. Oczekujemy na wyniki pierwszego konkursu ogłoszonego w 2019 roku przez ABM i liczymy na to, że oferowane przez Agencję finansowanie podniesie znacząco liczbę badań klinicznych niekomercyjnych.
Mogę potwierdzić, że trafiają do Urzędu protokoły badań proponujące innowacyjne rozwiązania, dotyczą one oczywiście badań prowadzonych w onkologii. Obszar farmakoterapii w onkologii to miejsce szczególnie ukierunkowane na badania nowoczesnych, nowatorskich leków, których rozwój budzi nadzieję na znalezienie skuteczniejszego oręża w nadal nierównej walce z nowotworami złośliwymi. Nowe rozwiązania są efektem zmiany w podejściu do charakteryzowania chorób i procesu leczenia czyli medycyny personalizowanej. Medycyna personalizowana opiera się na przekonaniu, że rozwój choroby, jej przebieg i odpowiedź na leczenie są procesami bardzo zróżnicowanymi, które mogą przebiegać odmiennie u różnych pacjentów, a choroba każdej osoby może być wyjątkowa i z tego względu potrzebne jest indywidualne podejście. Medycyna personalizowana, dzięki precyzyjnym narzędziom pozwala dobrać odpowiednie leczenie do konkretnego pacjenta w odpowiednim czasie. W związku z tym w sposobie rozwoju leków również zachodzą duże zmiany, toczą się dyskusje na temat przyszłości metodologii badań klinicznych, pojawiają się propozycje modyfikacji tradycyjnego podziału badań klinicznych na badania fazy I, II, i III. Oprócz znanych już od lat badań adaptacyjnych – badań w układzie elastycznym, w którym przeprowadza się analizy pośrednie i na tej podstawie wprowadza się modyfikacje do początkowego projektu, pojawiły się projekty badań parasolowych „umbrella trials” lub koszykowych „basket trials”. W tych pierwszych badany jest wpływ różnych produktów stosowanych w pojedynczym rodzaju nowotworu, natomiast w badaniach koszykowych odwraca się ten schemat i bada się wybrany produkt leczniczy w wielu rodzajach nowotworu (lub w różnych chorobach o wspólnym podłożu). Elastyczne podejście umożliwia uzyskanie większej ilości danych w krótszym czasie i tym samym może skrócić całkowity czas rozwoju produktu. Innowacyjne propozycje mogą umożliwić wcześniejsze zidentyfikowanie nieskutecznych badanych produktów i pozwolą na przesunięcie zasobów na bardziej obiecujące metody leczenia. Niewątpliwie jednak proces oceny nowatorskich protokołów jest dużo trudniejszy, właściwie są dopiero wypracowywane schematy oceny. Z perspektywy organu kompetentnego odejście od klasycznych modeli badań klinicznych wymaga przemodelowania tradycyjnych schematów oceny dokumentacji badania. Należy również pamiętać o ryzyku związanym z samym prowadzeniem badania, jego nadzorem i monitorowaniem w sytuacji, gdy w jednym badaniu mamy np. odrębne kryteria włączenia i wyłączenia dla kilku grup pacjentów. Badania tego typu powinny być projektowane i prowadzone przez wyspecjalizowane ośrodki, zapewniając odpowiednie bezpieczeństwo uczestnikom badań, dbając jednocześnie o jakość uzyskiwanych wyników.
Pracownicy Urzędu zostali wyznaczeni przez Ministra Zdrowia jako członkowie zespołu, który pod kierunkiem ABM przygotowywał projekt ustawy o badaniach klinicznych. Nasi przedstawicie brali udział w pracach plenarnych, jak również w pracach podgrup, skupiających się już na konkretnych tematach. Rolą Urzędu było przygotowanie części kompetencyjnej ustawy, dotyczącej postępowania w przedmiocie wydania pozwolenia na badanie kliniczne i, istotną zmianę, propozycji opłat oraz części dotyczącej inspekcji badań klinicznych. Chciałbym zwrócić uwagę, że zmiany w postępowaniu w przedmiocie wydania pozwolenia na badanie kliniczne w zakresie terminów, rodzaju składanej dokumentacji oraz zakresu oceny, wprowadziło Rozporządzenie 536/2014. Tam znajdują się innowacyjne rozwiązania, na które czekamy, takie jak portal i baza danych badań klinicznych.

W projektowanej ustawie o badaniach klinicznych najistotniejszą dla Urzędu częścią jest bez wątpienia część dotycząca organizacji komisji bioetycznych oraz proces wydawania opinii przez komisje – pamiętajmy, że organ kompetentny będzie musiał wydać jedną decyzję w państwie członkowskim; decyzja ta będzie wynikiem wspólnej etycznej i merytorycznej oceny dokumentacji badania klinicznego. Podstawą wypełnienia założeń Rozporządzenia 536/2014 będzie sprawna komunikacja pomiędzy komisją etyczną i organem właściwym dla wydawania decyzji odnośnie możliwości prowadzenia badania klinicznego. Ważnym tematem jest również ustanowienie systemów odszkodowawczych oraz określenie wymiaru odszkodowania i kary w przypadku szkody wyrządzonej uczestnikowi badania klinicznego. Obecnie zastosowany system odpowiedzialności cywilnej badacza i sponsora budzi wiele zastrzeżeń ponieważ w praktyce uniemożliwia uzyskanie odszkodowania przez uczestników badań klinicznych. Zaproponowane w ustawie rozwiązanie oparte na Funduszu gwarancyjnym oraz ubezpieczeniu OC badacza i sponsora powinno zmienić tę niekorzystną dla uczestników badań klinicznych sytuację.
Zgodnie z projektem Ustawy o badaniach klinicznych, który został przekazany do Ministerstwa Zdrowia organem właściwym do prowadzenia określonych w ustawie postępowania w zakresie badań klinicznych produktów leczniczych (m. in. wydania pozwolenia na badanie i zmianę istotną, cofnięcia lub zawieszenia badania klinicznego) będzie Prezes Urzędu Rejestracji PLWMiPB. Tak jak wspomniałem wcześniej Rozporządzenie 536/2014, na podstawie którego będziemy pracować w niedalekiej przyszłości wprowadza nowe warunki, wymagania, terminy zarówno dla organów kompetentnych, jak i dla sponsorów badań klinicznych. Niewątpliwie będzie to szansa na zniwelowanie wielu barier, jakie istnieją obecnie, ale jednocześnie będzie to dla nas wszystkich spore wyzwanie. Rolą rozporządzenia jest stworzenie warunków do prowadzenia badań klinicznych w UE z zachowaniem najwyższych standardów bezpieczeństwa uczestników badań. Celem wprowadzenia nowych przepisów jest również wzrost transparentności danych dotyczących badań klinicznych prowadzonych w UE. Przepisy wprowadzone przez Rozporządzenie pozwolą na uniknięcie wielokrotnego oceniania dokumentacji. Rozporządzenie wprowadza m.in.:
Każde zainteresowane państwo członkowskie będzie powiadamiać sponsora za pośrednictwem portalu UE, czy wydaje pozwolenie na badanie kliniczne, czy wydaje je pod pewnymi warunkami, czy też odmawia wydania pozwolenia. Powiadomienie będzie się odbywać w drodze jednej decyzji, badanie wymagać będzie jednak zarówno oceny naukowej, jak i etycznej. Przepisy Rozporządzenia pozwolą na harmonizację przepisów administracyjnych regulujących badania kliniczne i ograniczą do minimum różnice w podejściu do rejestracji badań klinicznych między państwami członkowskimi.
Od roku 2016, kiedy to Wielka Brytania podjęła decyzję o opuszczeniu struktur europejskich, trwa proces BREXIT-u, uruchomiony przez art. 50 Traktatu o Unii Europejskiej. Plany wyjścia Zjednoczonego Królestwa ze wspólnoty w szczególny sposób dotknęły Europejską Agencję Leków (EMA), gdzie zasiadam w Grupie Koordynatorów ds. Budżetu i Programu Prac. W minionym, 2019 roku doszło do finalizacji przenosin siedziby Agencji do Amsterdamu, procesu przygotowywanego od 2018 roku na poziomie Rady Zarządzającej. Przenosiny Agencji były jednym z największych wyzwań, nie tylko ze względu na techniczny aspekt związany z przeprowadzeniem ok. 900 osobowej instytucji do innego kraju, ale również ze względu na cały szereg implikacji, takich jak utrudnienia i ograniczenia w płynności realizacji wszystkich zadań Agencji, czy też problem utraty personelu, szacowany na ponad 20% stanu. Szerokie spectrum dotyczące spraw związanych z BREXIT-em uzupełnił w minionym roku także problem dostępności produktów leczniczych przeznaczonych dla ludzi i zwierząt. W tym kontekście EMA podjęła działania mające na celu zminimalizowanie skali problemu, m.in. za sprawą monitorowania i weryfikowania dostępności newralgicznych produktów leczniczych z wykorzystaniem systemów bazodanowych, a także, ze strony Urzędu, jako jednej z europejskich agencji, opiniowanie wniosków podmiotów odpowiedzialnych dotyczących wyrażania zgody na prolongatę terminu uznawania wyników badań w zakresie kontroli serii gotowego produktu leczniczego do końca 2019 r. Działania te realizowane były lub nadal są realizowane w związku z koniecznością przeniesienia tych miejsc z terytorium Wielkiej Brytanii do pozostałych państw członkowskich lub krajów objętych umową MRA. Mając na względzie niezwykłą rolę realizowanych zadań dotyczących wystąpienia Wielkiej Brytanii z UE, Urząd prowadzi na swojej stronie internetowej zakładkę „BREXIT”, gdzie zamieszczane są istotne informacje w tej tematyce wraz z przewodnikami postępowania, oraz często zadawanymi pytaniami i odpowiedziami dla produktów rejestrowanych centralnie, jak również w procedurach europejskich.
W dalszym ciągu czekamy na ostateczny terminarz dotyczącego ogłoszenia funkcjonalności portalu i bazy danych badań klinicznych, które na potrzeby Rozporządzenia 536/2014 buduje Europejska Agencja Leków. W grudniu 2019 r. Zarząd EMA zatwierdził rozpoczęcie audytu systemu w grudniu 2020 roku, oczywiście po ocenie gotowości do audytu przeprowadzonej przez wyznaczonych właścicieli produktów, EMA i dostawcę IT.
Z całą pewnością czekają nas jeszcze prace w zakresie projektu ustawy, na etapie konsultacji wewnętrznych jest jeszcze kilka tematów, które wymagają dopracowania. Konsultacje społeczne projektu również mogą przynieść wiele cennych uwag co do wypracowanych propozycji. Wyzwaniem jest przygotowanie do wspólnej oceny merytorycznej pod przewodnictwem państwa sprawozdawcy w ramach Rozporządzenia 536/14. Wspólna ocena wymaga wypracowania wspólnych zasad i zakresu wymagań. Musimy również przygotować naszych ekspertów do podjęcia roli sprawozdawcy. Taka ocena wymaga nie tylko wiedzy i doświadczenia w ocenianym badaniu, ale również umiejętności dyskusji i wypracowywania wspólnego stanowiska w międzynarodowym środowisku. Rozporządzenie 536/2014 wprowadzi również współpracę państw członkowskich przy ocenie sprawozdań dotyczących bezpieczeństwa badanych produktów leczniczych. W tym zakresie również musimy zdobyć potrzebne doświadczenie, potrzebujemy także odpowiedniej kadry ekspertów.
 Prezes Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Absolwent Wydziału Farmaceutycznego Akademii Medycznej w Warszawie o specjalizacji technologia przemysłowa. Doktor nauk o zdrowiu w dziedzinie farmakologii na I Wydziale Lekarskim Warszawskiego Uniwersytetu Medycznego. W latach 2001-2002 pracownik Instytutu Leków w Warszawie. Z Urzędem jest związany nieprzerwanie od czasu jego powstania. Był m.in. bezpośrednio odpowiedzialny za przeprowadzone w latach 2004- 2008 dostosowanie dokumentacji produktów leczniczych do wymogów prawa europejskiego, zgodnie z Traktatem o Przystąpieniu Rzeczypospolitej Polskiej do Unii Europejskiej. Od 2010 r. członek Rady Zarządzającej Europejskiej Agencji Leków (EMA), a od 2016 r. Wiceprzewodniczący Rady. Od 2012 r. jest jednym z trzech członków działającej w ramach Rady Zarządzającej Grupy Koordynacyjnej do Spraw Budżetu i Programu Prac EMA. Został również wybrany na Mentora Emacolex – Grupy Roboczej Prawników Agencji Leków Unii Europejskiej i Europejskiego Obszaru Gospodarczego. Uczestnicząc w sieci Szefów Agencji Leków Unii Europejskiej i Europejskiego Obszaru Gospodarczego koncentruje swoje działania na zapewnieniu harmonijnej współpracy narodowych agencji regulacyjnych w ramach przyjętej przez te agencje wspólnej strategii działania w zakresie dopuszczania do obrotu i monitorowania bezpieczeństwa stosowania produktów leczniczych.
Prezes Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Absolwent Wydziału Farmaceutycznego Akademii Medycznej w Warszawie o specjalizacji technologia przemysłowa. Doktor nauk o zdrowiu w dziedzinie farmakologii na I Wydziale Lekarskim Warszawskiego Uniwersytetu Medycznego. W latach 2001-2002 pracownik Instytutu Leków w Warszawie. Z Urzędem jest związany nieprzerwanie od czasu jego powstania. Był m.in. bezpośrednio odpowiedzialny za przeprowadzone w latach 2004- 2008 dostosowanie dokumentacji produktów leczniczych do wymogów prawa europejskiego, zgodnie z Traktatem o Przystąpieniu Rzeczypospolitej Polskiej do Unii Europejskiej. Od 2010 r. członek Rady Zarządzającej Europejskiej Agencji Leków (EMA), a od 2016 r. Wiceprzewodniczący Rady. Od 2012 r. jest jednym z trzech członków działającej w ramach Rady Zarządzającej Grupy Koordynacyjnej do Spraw Budżetu i Programu Prac EMA. Został również wybrany na Mentora Emacolex – Grupy Roboczej Prawników Agencji Leków Unii Europejskiej i Europejskiego Obszaru Gospodarczego. Uczestnicząc w sieci Szefów Agencji Leków Unii Europejskiej i Europejskiego Obszaru Gospodarczego koncentruje swoje działania na zapewnieniu harmonijnej współpracy narodowych agencji regulacyjnych w ramach przyjętej przez te agencje wspólnej strategii działania w zakresie dopuszczania do obrotu i monitorowania bezpieczeństwa stosowania produktów leczniczych.


Rozmawiał: Dariusz Olszewski,
Redaktor Naczelny, Badania Kliniczne
Z pewnością tak. Plan Rozwoju Badań Klinicznych stanowi dokument ramowy, który powstawał w okresie kształtowania się Agencji Badań Medycznych i miał na celu nadać pewne systemowe ramy funkcjonowania rynku badań klinicznych w Polsce. PRBK będzie zapewne podlegał uaktualnianiu i zmianom, ponieważ badania kliniczne ciągle się rozwijają. W Polsce czynione są nowe inwestycje, zmienia się otoczenie prawne. Warto podkreślić, że plan przedstawiony w PRBK jest realizowany i że jest to uchwała Rady Ministrów. W dużej mierze jest to zobowiązanie, które Premier i Rada Ministrów podjęli wobec całego społeczeństwa po to, aby ten obszar rozwijać. Konsekwentnie już we wrześniu 2019 r. uruchomiliśmy pierwszy konkurs na 100 mln zł, który lada dzień zostanie rozstrzygnięty. Sam jestem ciekaw, które projekty uzyskają dofinansowanie, czego będą dotyczyły i jakie kwoty będą przekazane na poszczególne projekty. W styczniu 2020 r. na ręce Ministra Zdrowia przekazaliśmy projekt ustawy o badaniach klinicznych, która zmienia otoczenie legislacyjne. Ponadto, wchodzimy odważnie w obszar immunoterapii, za kilka tygodni ogłosimy kolejny konkurs na badania z przeciwciałami rekombinowanymi w zakresie CAR-T cell, a w drugiej połowie roku ogłosimy konkurs na zastosowania sztucznej inteligencji w medycynie, szczególnie w onkologii. Wsparcie, o którym jest mowa w PRBK ma miejsce i z każdym miesiącem będziemy realizowali kolejne, zaplanowane działania.
Całkowicie wywiązaliśmy się z projektu ustawy o badaniach klinicznych. To, co miało być zrobione po stronie ABM, zostało wykonane. Prace były prowadzone sprawnie w dość szerokim gremium, a proponowane rozwiązania konsultowane już na tym etapie. Myślę, że wszyscy zaadresowali tam swoje potrzeby. Teraz czekamy na ruch Ministra Zdrowia, który podtrzymuje swoje deklaracje, że jeszcze w pierwszym kwartale tego roku ustawa zostanie skierowana do prac parlamentarnych. Przyznane środki wydatkujemy zgodnie z planem, już za dwa tygodnie zostanie ogłoszony konkurs na kolejne 200 mln zł, a w 5-letnim okresie założyliśmy wydatkowanie miliarda zł.
Patrząc na systemowe działania, również infrastruktura badawcza i organizacyjna pod postacią Centrów Wsparcia Badań Klinicznych też już się tworzy. W połowie marca będziemy ogłaszali konkurs na Centra Wsparcia Badań Klinicznych o łącznej alokacji 100 mln zł. W szpitalach wysokiego stopnia referencyjności, a więc w szpitalach uniwersyteckich, szpitalach klinicznych czy instytutach Ministra Zdrowia, pozwoli to stworzyć bardzo wysoko standaryzowane CWBK, które nie będą ustępowały podobnym strukturom na zachodzie Europy. Badania kliniczne w Polsce będą dzięki temu prowadzone w sposób bardziej przyjazny dla szpitala i pacjenta. Zostaną wydzielone i ustrukturyzowane ośrodki kosztów. To spowoduje, że Polska stanie się jeszcze bardziej atrakcyjnym krajem dla inwestorów zagranicznych i pojawi się ich więcej. Ten punkt planu będzie realizowany lada moment.
Ostatnia rzecz to uruchomienie portalu „Pacjent w badaniach klinicznych”, a więc komunikacja skierowana do pacjentów. To część procesu, który powinien zakończyć się w ciągu 2 lat, a jego celem jest stworzenie obiektywnego portalu wiedzy o badaniach klinicznych. Finalnie, mam nadzieję w przyszłym roku, utworzymy krajową wyszukiwarkę badań klinicznych, w której każdy będzie mógł znaleźć badanie kliniczne, do którego jest potencjalnym kandydatem, dowiedzieć się gdzie ono jest realizowane i czy wciąż trwa rekrutacja. Zatem będzie to spora, pozytywna zmiana jeśli chodzi również o pacjentów.
Mamy już wstępne statystyki. Wpłynęło do nas 77 wniosków na łączną kwotę – uwaga – 1,5 mld zł. Zatem wnioski 15-krotnie przewyższyły alokowane środki. To pokazuje mandat i potrzebę istnienia naszej instytucji. Jeśli przewidujemy, że chcemy przeznaczyć 100 mln zł., a wniosków wpływa na 1,5 mld, to znaczy, że naukowcy przez wiele lat nie mieli możliwości finansowania swoich badań. Teraz ten potencjał ujawnił się i wybuchł. Pierwszy konkurs zakończymy w pierwszym lub drugim tygodniu marca, w połowie marca będziemy mogli zaprezentować listy rankingowe i wyłonić beneficjentów. Bardzo się z tego cieszymy, mamy szeroki wybór, to świadczy, że projekty będą wysokiej jakości. Mamy również sygnały, że część naukowców nie zdążyła przygotować wniosków w listopadzie, są też osoby, które szykują się już na następny konkurs, który będzie o wiele szerszym.
W pierwszym konkursie mówiliśmy tylko o produktach leczniczych i to wykraczających poza charakterystykę produktu leczniczego, teraz dołączamy wyroby medyczne, które mają duży potencjał krajowy, dołączamy też całą telemedycynę i medycynę cyfrową, a więc także i produkty z zakresu ATM oraz pojedyncze związki chemiczne.
Drugi konkurs będzie blokowy i adresuje te same obszary, jak w przypadku pierwszego konkursu. Dokładamy jednak kolejne możliwości aplikowania dla kolejnych grup produktów. Wynika to z szerokiego otwarcia się na środowisko akademickie, na naukowców. ABM jest instytucją dla pacjentów, dla lekarzy i dla badaczy i jeżeli dostajemy sygnały, że jest coś, co jest potrzebne polskim pacjentom, np. jakaś technologia, która jest dojrzała i należy ją doprowadzić do finalnego zastosowania, to oczywiście przy pomocy naszej Rady Naukowej decydujemy, czy to jest droga, którą powinniśmy podążać i organizujemy konkurs. Efektem tego działania jest poszerzenie katalogu potencjalnych beneficjentów, którzy znajdą się w kolejnym konkursie.
Przede wszystkim stawiamy sobie pytanie, czy staniemy się członkiem ECRIN-u. Na odpowiedź dajemy sobie 3 lata. Do tego momentu będziemy korzystać z dobrodziejstw tej sieci badań klinicznych, nie płacąc jednocześnie tak dużych danin jak regularni członkowie i przyglądając się, jaka wartość płynie z takiego członkostwa. Wiemy, że każde sieciowanie i budowanie partnerstwa międzynarodowego w każdej branży jest bardzo cenne, bo pozwala nawiązać międzynarodowe relacje, budować wiarygodność kraju. Z perspektywy UE cały czas jesteśmy postrzegani raczej jako kraj Europy środkowo-wschodniej, a nie równoważny partner taki jak Niemcy, Francja czy Hiszpania. Tymczasem nie mamy się czego wstydzić, zwłaszcza w obszarze badań klinicznych. Spodziewamy się, że napływ zaproszeń dla polskich ośrodków badawczych będzie się zwiększał, w związku z tym, zwiększymy liczbę niekomercyjnych badań klinicznych. Jeżeli za 3 lata okaże się, że badań będzie więcej, rekrutacje będą wyższe i Polska zacznie być postrzegana jako atrakcyjne miejsce prowadzenia takich badań, to na pewno będziemy chcieli wnioskować o pełnoprawne członkostwo w ECRIN. Jeżeli nie – będziemy szukać innej drogi. W tej chwili pomysł rozwija się dobrze, przygotowujemy krajowy odpowiednik sieci o nazwie POLCRIN ze swoją stroną internetową, koordynatorami, standaryzujemy ośrodki, które wejdą do ECRIN. Na początku lutego na stanowisko Reprezentanta Krajowego POLCRIN powołany został dr hab. n. med. Tomasz Hryniewiecki (Dyrektor Narodowego Instytutu Kardiologii w Warszawie). Jego zastępcami zostali: prof. dr hab. n. med. Marcin Moniuszko (Prorektor ds. Nauki i Rozwoju Uniwersytetu Medycznego w Białymstoku) oraz prof. dr hab. med. Jan Maciej Zaucha (Kierownik Katedry i Kliniki Hematologii i Transplantologii Gdańskiego Uniwersytetu Medycznego). Dr n. med. Marek Migdał (Dyrektor Instytutu „Pomnik – Centrum Zdrowia Dziecka” w Warszawie) został Koordynatorem Krajowym ds. Badań Pediatrycznych.
Centrum Edukacji to jednostka wydzielona w ramach ABM, która ma za zadanie wspierać rozwój obiektywnej wiedzy o badaniach klinicznych poprzez treści adresowane do pacjentów oraz specjalistów.
Ostatnio odezwał się do nas dziekan wydziału medycznego Uniwersytetu Harvarda, którego mieliśmy okazję wizytować w ubiegłym roku z Panem Ministrem Szumowskim. Okazuje się, że po tym spotkaniu zostaliśmy zidentyfikowani jako potencjalny partner. Uniwersytet Harvarda chciałby przeprowadzić z nami serię swoich szkoleń, certyfikować polskich badaczy i według swoich światowych standardów uczyć, jak prowadzić badania kliniczne. W tej chwili jesteśmy w trakcie rozmów i wierzę, że w przyszłym roku będziemy mogli wspólnie podjąć się organizacji takich szkoleń. To dobry sygnał, kiedy Amerykanie sami dzwonią, mówią „zróbmy coś razem, macie jednostkę, macie pieniądze, widać, że to u was idzie”.
ABM jako jednostka młoda, wciąż się rozwija. Myślę, że Centrum Edukacji nabierze pełnej mocy operacyjnej z końcem tego roku i początkiem przyszłego, i będzie ono odpowiadało za działania edukacyjne. Jako instytucja rządowa jesteśmy i powinniśmy być odpowiedzialni za przekazywanie takiej wiedzy i za takie działania. W tej chwili tego typu inicjatywy funkcjonują przy różnych stowarzyszeniach czy organizacjach. Pacjenci mają jednak zawsze cień wątpliwości, na jakich zasadach i z jakimi intencjami są te działania prowadzone. My chcemy te wątpliwości rozwiać.
Działania parosolowe zawsze są lepsze niż wielość działań punktowych, lokalnych i będziemy chcieli je zebrać w ramach ABM. Naturalnym jest, że kiedy duża jednostka zawiadująca danym rynkiem podejmuje jakieś działania, to siłą rzeczy staje się ich liderem.
Jestem przekonany, że jeśli organizacje pacjenckie czy inne inicjatywy będą chciały się afiliować i uczestniczyć w naszych działaniach edukacyjnych, to jest na to przestrzeń. Nikt na tym nie traci, wręcz przeciwnie, myślę, że będziemy zyskiwać, bo organizacje pacjenckie mają dużą siłę przebicia – mają grupy stałych pacjentów, zespoły lokalne, odbywają spotkania w szpitalach.
W tej chwili nie będzie to możliwe. Wynika to bardziej z uwarunkowań legislacyjnych, a nie naszych przekonań. Największą siłę mają uniwersytety i instytuty badawcze, ponieważ to one pozwalają na tworzenie badań dobrej jakości. Badania i tak się tam toczą, są tam odpowiednie kadry, profesorowie, są kliniki, które mają ekspertyzę w tym zakresie. Na Centra Wsparcia Badań Klinicznych przeznaczone są pieniądze publiczne, które mają służyć pacjentom i stąd też przyznanie dotacji publicznej podmiotowi prywatnemu byłoby niezasadne z punktu widzenia wydatkowania środków publicznych. Jednocześnie zakładamy, że Centra Wsparcia Badań Klinicznych będą rentowne.
To powinny być samofinansujące się przedsięwzięcia w ramach szpitala, które będą zarabiały na siebie i będą dokładały do budżetu szpitala dodatkowe pieniądze. Chcemy pokazać wszystkim, także dyrektorom szpitali, że te inicjatywy są ze wszech miar dobre, bo dokładają środki finansowe dla szpitala, zwiększają dostępność badań dla pacjentów, ale też pozwalają kadrze na dodatkowe źródło zarobkowania. Nie jestem przekonany, czy w wypadku prywatnych jednostek byłoby właściwe, żeby rządowa instytucja finansowała takie działania.
Cieszę się, że przejęliśmy ten projekt z PFR, który go rozpoczął. Jesteśmy instytucją, która zajmuje się badaniami i to najwłaściwsze miejsce, aby zajmować się tym projektem. To jest wartościowa inicjatywa będąca efektem zaangażowania głównie organizacji pacjenckich i strony rządowej, która na to odpowiedziała. W planach mamy między innymi utworzenie krajowej wyszukiwarki badań. Te działania wspólnie doprowadzą do dużego sektorowego działania, aby pacjenci czuli się w badaniach bezpiecznie. To jest nasz cel.
Zaproponowaliśmy zmianę zapisu dotyczącego niefortunnego pojęcia „powikłania zdrowotne”. Nie wiadomo było, czym właściwie są te powikłania – czy są efektem badania klinicznego, czy może wynikają z innych okoliczności. Kiedy dochodziło do sporu w tej kwestii, wówczas wszyscy się od tego odżegnywali. NFZ prezentował stanowisko, że to nie ich wina, iż ktoś brał udział w badaniu, natomiast sponsor często twierdził, że właściwie są to powikłania, które wykraczają poza badanie leku i nie mają z nim związku. Słowo „powikłania” zmieniliśmy na „działania niepożądane” i dość jasno precyzujemy katalog tych działań. Każdy będzie wiedział, że jeśli wydarzy się „X” to płaci NFZ , a jeśli „Y” to odpowiedzialność finansową ponosi sponsor. To sprawia, że wszystko od początku jest jasne. Katalog działań niepożądanych jest określony w załączniku do ustawy i wynika z rozporządzeń i regulacji europejskich. Harmonizujemy więc przepisy krajowe z prawem europejskim.
Projekty są już przygotowane, zespół wypracował akty wykonawcze. Oczywiście wymaga to jeszcze pracy parlamentarnej, rządowej i pewnie szczegółowe zapisy będą podlegały zmianom, ale myślę, że zmiany te będą raczej kosmetyczne niż fundamentalne.
Tak. Chcieliśmy, żeby specjaliści w danej dziedzinie wypracowali te rozwiązania. Na tym etapie nie było to dyskutowane w ramach szerokiego gremium i jest w tym konsekwencja, którą są przepisy spójne z ustawą. Tak było m.in. z ubezpieczeniami, pomocą de minimis. Staraliśmy się, aby te kwestie adresować do wąskich grup eksperckich. Przez ostatnie dwa tygodnie miałem okazję spotykać się także z kilkoma firmami, które dobrze się o tym akcie wypowiadały podkreślając, że jest to przykład dobrej praktyki legislacyjnej i szerokiej konsultacji. Zobaczymy, jakie będą dalsze działania resortu, ale jesteśmy dobrej myśli. W mojej opinii akt jest dobrze przygotowany.
Najbardziej cieszę się z dwóch obszarów ujętych w projekcie ustawy. Pierwszym jest utworzenie Funduszu Gwarancyjnego przy ABM oraz powołanie Naczelnej Komisji Bioetycznej. Pozwala nam to mieć pełen obraz tego, co dzieje się na rynku badań klinicznych w Polsce. Jednocześnie umożliwia to pacjentom bardzo szybko dochodzić swoich roszczeń, jeżeli takowe wystąpią. Myślę, że jest to duże otwarcie się na pacjentów, zwiększenie ich poczucia bezpieczeństwa, ale też ułatwienie dla uczestników badań. Kiedyś trudno było pacjentowi stanąć naprzeciw wielkiego koncernu, mieliśmy do czynienia choćby z różną wielkością zaangażowania finansowego. Tu pacjent traktowany jest jak równy z równym, a właściwa komisja się na ten temat wypowiada. W momencie, kiedy ten obszar będzie przypisany do ABM, to będzie właściwe miejsce, aby się temu przyglądać i wyciągać wnioski, i myśleć o ewentualnych zmianach ustawowych.
Drugim obszarem jest kwestia ubezpieczeń. Przez wiele lat nie udawało się tego tematu rozwiązać. Zakładamy, że badania kliniczne o niskim stopniu interwencyjności nie będą podlegały ubezpieczeniu przez sponsora, bo są to badania, które zwykle nie powodują działań niepożądanych. Takie badania mają bardzo niski potencjał szkodliwości, tymczasem stawki ubezpieczeniowe były bardzo wysokie. Taka jest praktyka europejska, tak dzieje się np. w krajach skandynawskich. Mam nadzieję, że tych badań o niskim stopniu interwencyjności w Polsce będzie też dużo więcej.
Z prezesami agencji ochrony zdrowia działamy na zasadzie gentlemen’s agreement, tzn. działamy w tym samym kierunku i gramy do jednej bramki. Wszelkie problemy natury np. legislacyjnej dawało się rozwiązać na zasadach dobrej współpracy, po prostu spotykaliśmy się z ludźmi kompetentnymi. To porozumienie z URPL jest formalizacją przepływu informacji, żebyśmy my jako ABM mieli całkowity dostęp do informacji, np. jakie badania są rejestrowane, jakie są wyniki kontroli. Jest nam to potrzebne do organizowania ładu rynku badań klinicznych, również komercyjnych. Nie zmienia to dobrej praktyki, którą wypracowaliśmy i w ramach której co najmniej dwa razy w tygodniu mam kontakt z pracownikami URPL. Jest to bardzo owocna współpraca i myślę, że także niezbędna. Udaje nam się wychodzić z silosowości, co daje w rezultacie pozytywne, wymierne efekty. Nadal będziemy tak działać.
Myślę że tak, na pewno będzie to jeden adresat. Nie będzie sytuacji, że część spraw trafi do ABM, a część do URPL. Interpretacja prawa jest jedna, adresat powinien być jeden. Na poziomie ustaleń merytorycznych będziemy się konsultować w razie potrzeby.
Bardzo dziękuję za rozmowę. Życzę powodzenia i konsekwencji w realizacji zamierzeń.
 (ur. w 1988 w Dąbrowie Górniczej)
(ur. w 1988 w Dąbrowie Górniczej)
Polski lekarz specjalizujący się w kardiologii i menedżer, specjalizujący się w zarządzaniu w sektorze medycznym, badaniach klinicznych, Health Technology Assessment (HTA) i managemencie nauki, pełniący obowiązki prezesa Agencji Badań Medycznych. Jest absolwentem I Wydziału Lekarskiego na Warszawskim Uniwersytecie Medycznym. W czerwcu 2018 roku doktoryzował się w Instytucie Kardiologii na podstawie pracy doktorskiej „Jednoośrodkowe wyniki wieloośrodkowego Rejestru Burz Elektrycznych RECOVERY”. Jest autorem publikacji naukowych, popularnonaukowych i wystąpień na międzynarodowych kongresach medycznych w zakresie kardiologii, telemedycyny i organizacji ochrony zdrowia. Pracował w Klinice Zaburzeń Rytmu Serca w Instytucie Kardiologii oraz prywatnych jednostkach opieki zdrowotnej w charakterze lekarza oraz dyrektora medycznego. W 2018 roku został powołany w skład gabinetu politycznego ministra zdrowia Łukasza Szumowskiego jako doradca. W obszarze jego zainteresowań znajdują się w szczególności innowacyjne technologie, zarządzanie oraz komercjalizacja badań. Jest członkiem Rady Narodowego Centrum Badań i Rozwoju reprezentujący Ministra Zdrowia oraz zespołów eksperckich przy Ministrze Zdrowia. Przewodniczący Rady Społecznej Śląskiego Centrum Chorób Serca w Zabrzu oraz wiceprzewodniczący Rady Społecznej OW Mazowieckiego NFZ. Współpracował z Fundacją i Stowarzyszeniem Serce dla Arytmii.

Rozmawiał: Dariusz Olszewski,
Redaktor Naczelny, Badania Kliniczne
W Centrum Onkologii-Instytucie badania kliniczne są prowadzone od wielu lat, są to badania kliniczne głównie II-IV fazy dedykowane wyłącznie chorym onkologicznie. W 2017 r. przed otwarciem Oddziału Badań Wczesnych Faz (OBWF) w Centrum Onkologii-Instytucie w Warszawie prowadzono ponad 200 onkologicznych badań klinicznych, choć badania kliniczne wczesnych faz należały do rzadkości. Zdecydowaną większość stanowiły badania komercyjne, ale prowadzono również badania niekomercyjne. Powodem powstania OBWF była pewnego rodzaju bezsilność w walce z rzadko występującymi nowotworami rozwijającymi się u osób, którzy pomimo wyczerpania możliwości standardowej terapii nadal byli w bardzo dobrym stanie ogólnym.
Wywodzę się z Kliniki Nowotworów Tkanek Miękkich, Kości i Czerniaków Centrum Onkologii-Instytutu w Warszawie, gdzie zawsze ważne było i jest wielodyscyplinarne postępowanie zgodnie ze standardami onkologicznymi, a także prowadzenie badań klinicznych nad nowymi opcjami terapeutycznymi. Dla chorych na czerniaki, szczególnie w ostatnich latach pojawiło się bardzo wiele opcji terapeutycznych, zarówno jako leczenie standardowe, jak i w ramach badań klinicznych, ale dla chorego ze zdiagnozowanym mięsakiem możliwości są ograniczone. Mięsaki należą do grupy nowotworów rzadko występujących i stąd, przez ograniczone możliwości rekrutacyjne, nie są przedmiotem zainteresowania koncernów farmaceutycznych. Nowe terapie mogą być dostępne w ramach nielicznych niekomercyjnych badań klinicznych. Chory na mięsaka to często młody człowiek, bez żadnych dolegliwości, bez internistycznych obciążeń, dla którego rozpoznanie jest wyrokiem. Osobiście trudne było dla mnie ograniczenie wynikające z braku możliwości zaproponowania takim pacjentom czegoś więcej niż standardowe leczenie, stąd naturalnym kierunkiem było prowadzenie badań pierwszej fazy zwykle dedykowanych chorym bez wskazywania konkretnego podtypu histologicznego.
Z drugiej strony wiedzieliśmy też, że taka instytucja jak Centrum Onkologii-Instytut z zapleczem infrastrukturalnym umożliwiającym prowadzenie badań przedklinicznych powinna mieć bazę do realizacji wszystkich rodzajów badań klinicznych, tj. od pierwszej do czwartej fazy. Do tego doszła możliwości współpracy z lokalnym, polskim przemysłem farmaceutycznym zainteresowanym rozwojem cząsteczki o działaniu przeciwnowotworowym. W 2015 roku pozyskaliśmy różne źródła finansowania, w tym z NCBR, z Centrum Naukowo-Przemysłowego utworzonego wspólnie z firmą Roche, co skutkowało otwarciem w czerwcu 2017 roku pierwszego w Polsce onkologicznego Oddziału Badań Wczesnych Faz (OBWF).
Z chwilą otwarcia OBWF zdecydowano, że badania kliniczne II-IV fazy nadal będą realizowane w klinikach narządowych z uwagi na to, że dotyczą konkretnie określonych histologicznie grup pacjentów, tam jest zagwarantowana zarówno odpowiednia rekrutacja chorych, ekspertyza, jak i wielodyscyplinarna opieka nad pacjentami.
Dziś mogę z pewnością powiedzieć, że poziom zainteresowania chorych udziałem w badaniach wczesnych faz, a także liczba propozycji, które otrzymujemy od wiodących koncernów farmaceutycznych, przerosły moje początkowe oczekiwania. Zrealizowałam założenie stworzenia dostępu do nowych, potencjalnych terapii dla chorych, którzy wyczerpali dostępne możliwości terapeutyczne, a są nadal w dobrym stanie ogólnym.
Dwa lata temu nie spodziewałam się aż tak dużego zainteresowania naszym ośrodkiem, bo wiedziałam, że uczestnictwo w badaniach pierwszej fazy to jest pierwsza liga i że nie będzie łatwo przekonać sponsorów, aby nam zaufali i zlecili prowadzenie bardzo skomplikowanych badań wczesnych faz. Zakładałam też, że dziesięć badań wczesnych faz rocznie będzie sukcesem, tymczasem przez 2 lata działalności osiągnęliśmy liczbę 26 otwartych badań pierwszej fazy, a w listopadzie 2019 r. otwierane są trzy kolejne badania, co oznacza, że będzie ich łącznie 29. Kolejne badania są na etapie przygotowań i negocjacji. Bardzo ważne jest uzmysłowienie sobie, że w badaniu I fazy na poziomie ośrodka najczęściej można zakwalifikować pojedynczych chorych, bo są to badania, które dotyczą z reguły rekrutacji około 30-50 chorych w świecie, a jednocześnie nie ma miejsca nawet na najdrobniejszą pomyłkę. Ponadto zaangażowanie zespołu, a w szczególności badacza głównego jest zdecydowanie większe niż w III fazie badań klinicznych. Ciągłe telekonferencje z zespołem badawczym – sponsorem i z innymi badaczami – mające na celu omówienia bezpieczeństwa chorych biorących udział w badaniu, czy wprowadzanie modyfikacji w badaniu – to nasza codzienność.
Niewątpliwym sukcesem oddziału jest to, że sponsorzy postrzegają nas przez pryzmat wysokiej jakości realizacji badań i dlatego są zainteresowani realizacją nowych projektów. Obecnie współpraca dotyczy największych, globalnych sponsorów, takich jak Roche, BMS, Merck, Pfizer, Novartis czy Jansen. Chociaż też realizujemy wiele badań wspólnie z mniejszymi firmami biotechnologicznymi, np. z Agenusem, Macrogenics, Incyte, czy z polską firmą Celon Pharma (projekt CELONKO). Projekt CELONKO jest szczególny, ponieważ jest to pierwsze w Polsce badanie z pierwszym podaniem nowego związku przeciwnowotworowego u człowieka. Środki na realizację projektu pochodzą w części z NCBR w ramach programu STRATEGMED 2.
Badania pierwszej fazy, które są teraz realizowane w ośrodku to są badania z cząsteczkami ukierunkowanymi molekularnie w monoterapii lub w kombinacji z immunoterapią. Nie mamy żadnych badań z wykorzystaniem chemioterapii. Prawie wszystkie badania odbywają się w trybie ambulatoryjnym, w przypadku powikłań chory jest hospitalizowany w odpowiedniej klinice narządowej. Są to przede wszystkim badania komercyjne, ale obecnie pracujemy nad koszykowym badaniem niekomercyjnym zainicjowanym przez mój zespół. Agencja Badań Medycznych uruchomiła konkurs dotyczący badań niekomercyjnych. Planujemy do niego przystąpić aplikując o grant, choć w mojej ocenie badania niekomercyjne wczesnych faz są największym wyzwaniem. Nasze doświadczenie w tym zakresie zdobyliśmy dzięki zaangażowaniu w badania prowadzone wspólnie z Europejską Organizacją Zajmującą się Badaniami i Leczeniem Onkologicznym (EORTC), czy dzięki badaniom inicjowanym przez badaczy – tzw. IIS (red: Investigators initiated studies).
Tak, mamy bardzo duże doświadczenie w samodzielnym prowadzeniu badań niekomercyjnych, dzięki prowadzonym badaniom o takim charakterze w projektach unijnych czy badaniom realizowanym wspólnie z EORTC lub IIS. Wiemy dobrze z czym się taki projekt wiąże, wiemy, że jest to duże wyzwanie – począwszy od przygotowania całej dokumentacji badania, w tym protokołu, jak również zorganizowanie zarządzania takim przedsięwzięciem. W takim projekcie to jednostka pełni rolę ośrodka i sponsora jednocześnie, konieczne jest zaangażowanie zarówno lekarzy jako współbadaczy, naukowców zajmujących się badaniami translacyjnymi, zespołu koordynatorów, zespołu pielęgniarskiego, osób pełniących funkcję monitora badań klinicznych (ang. clinical research associate, CRA), jak i osób zajmujących się analizą i zarządzaniem bazą danych, specjalistów odpowiedzialnych za finansowanie, a także innych ekspertów – to jest bardzo interdyscyplinarne przedsięwzięcie, ale takie kompetencje i infrastrukturę w Centrum Onkologii-Instytucie mamy.
Uważam, że powołanie ABM jest zasadne i że jest to dobry kierunek. Badania kliniczne niekomercyjne w onkologii, ale też w innych dziedzinach, jak np. pediatria, są kluczowe. ABM ma na celu umożliwiać realizację takich badań. W chwili obecnej jest możliwość aplikowania do konkursu, więc aplikujemy i my z naszymi pomysłami popartymi potrzebą kliniczną. Pan Prof. Piotr Czauderna, Prezes ABM, to osoba z ogromnym doświadczeniem zarówno jako badacz, lekarz, jak i menedżer, więc konkludując – ja jestem dobrej myśli.
Z punktu widzenia lekarza – praca bezpośrednio z pacjentem w badaniu prowadzonym w klinice narządowej w porównaniu do badania na oddziale wczesnych faz nie różni się. Jednak z perspektywy pacjenta różnica jest istotna, bo to chory musi być przygotowany na zaakceptowanie dużej niewiadomej co do bezpieczeństwa i co do skuteczności proponowanych przez nas terapii. Pacjent w badaniu pierwszej fazy jest często w bardzo dobrej formie, spełnić musi wszystkie kryteria określone w protokole badania – znacznie bardziej restrykcyjne niż w kwalifikacji do badania trzeciej fazy czy leczenia standardowego oraz musi jednocześnie zaakceptować konieczność wykonywania licznych procedur, których nie przeprowadza się w trakcie leczenia standardowego, np. ponownej biopsji guza (czasem wykonać ją należy dwukrotnie). Ponadto często pobierane są próbki krwi, np. do oceny farmakokinetyki, czy inne procedury określone w protokole badania.
Myślę więc, że komunikacja z pacjentem jest inna, chory wymaga bardzo dużo czasu. Szczególnie na samym początku przed zdecydowaniem się na udział w badaniu, aby zrozumieć na co się decyduje, zarówno pod względem merytorycznym, jak i logistycznym. Chory musi być poinformowany o ryzykach, o całej naszej przyszłej współpracy i powinien to zaakceptować. Natomiast jeśli wystąpią działania niepożądane, to my jesteśmy dla chorego pierwszym kontaktem – pacjent musi do nas zadzwonić i nas poinformować, a naszą rolą jest zapewnienie mu bezpieczeństwa, które jest dla mnie najważniejsze.
Ten proces u nas w oddziale w przypadku każdego pacjenta trwa od minimum jednej do najczęściej dwóch, trzech godzin. Czasem pacjent potrzebuje zastanowić się, porozmawiać z bliskimi. Zgodnie z GCP chory musi mieć czas na zastanowienie, konieczne jest wyjaśnienie wątpliwości, a także przedstawienie zasad udziału w badaniu klinicznym. Proces kończy się złożeniem podpisów na formularzu – osobiście jest to dla mnie najważniejszy moment w badaniu.
Zawsze mnie zastanawia, jak bardzo chory – który już nie ma możliwości leczenia – jest zdeterminowany. Przez ostatnie dwa i pół roku, odkąd proponuję udział pacjentom w badaniach pierwszej fazy, tylko jeden pacjent odmówił. W tej chwili w oddziale mamy ponad 400 uczestników badań. To są różne badania, niektóre np. na etapie prescriningu wymagają potwierdzenia odpowiedniego markera, inne są dedykowane chorym na guzy lite. Są też badania dla chorych, u których stwierdzono progresję choroby na drugiej linii leczenia i skończyły się dla nich opcje leczenia finansowanego przez NFZ, gdyż większość programów lekowych określających dostęp do terapii onkologicznych dotyczy najczęściej dwóch linii leczenia chorych w stadium rozsiewu. W OBWF leczenie otrzymać mogą chorzy w stadium rozsianym choroby, pod warunkiem że są w dobrym stanie ogólnym oraz spełnią inne, liczne kryteria niezbędne do włączenia do badania klinicznego. Pyta Pan o ich reakcję? – najczęściej przyjeżdżają do nas od razu z nastawieniem wyrażenia zgody niezależnie od ograniczeń, o których mówiłam im wcześniej. Pacjenci często mówią, że są postawieni pod ścianą, dlatego decydują się na wszystkie nasze ograniczenia związane z badaniami pierwszej fazy, a to oznacza też i akceptację wielkiej niewiadomej co do bezpieczeństwa i co do skuteczności terapii.
Właściwie to wspólnie z chorym ustaliliśmy, że to nie jest właściwy moment na udział w badaniu. W czasie rozmowy okazało się, że chory był w trakcie leczenia onkologicznego, które kontrolowało jego chorobę. Jednocześnie w tym konkretnym badaniu, które było dostępne – kwalifikacja mogła dotyczyć osób z progresją choroby lub będących w trakcie leczenia. Zgodziliśmy się wspólnie, że lepsze jest dla chorego dalsze leczenie standardowe, a do udziału w badaniu klinicznym wrócimy jeśli dojdzie do progresji choroby.
Warto pochylić się nad kwestią dokumentacji oraz biurokracji. Wrócę choćby do formularzy zgód dla pacjenta: podstawowa zgoda do zapoznania się to niekiedy 50 stron medycznego tekstu dostosowanego do osób niezwiązanych z medycyną, dalej kilkanaście stron dotyczących badań naukowych, translacyjnych, kolejna zgoda związana z RODO, do tego jeszcze jedna informacja drobnym druczkiem o ubezpieczeniu. Mamy obowiązek i dochowujemy należytej staranności, ażeby pacjent naprawdę przeczytał tę dokumentacje, wymagamy tego od niego i pomagamy w tym, żeby zrozumiał na co się godzi. Z drugiej strony wiemy również, że dla niektórych chorych jest to literatura ich całego życia. Myślę, że jest to przestrzeń do zmiany, aby dokumentację dla pacjenta tworzyć bardziej syntetyczne, bardziej transparentnie. Mam jeszcze drugie, ale mniejsze życzenie – jest to integracja danych między systemami, aby nie było już konieczności przepisywania danych z jednego systemu do drugiego. To jest prozaiczne, ale praktyczne.
Jestem najbardziej dumna z tego, że pomagam ludziom, że leki, które są u nas w oddziale naprawdę działają, a większość pacjentów – którzy przyszli do nas z potwierdzoną progresją choroby – ma stabilizację lub zmniejszenie się zmian nowotworowych. Jestem też bardzo dumna z tego, że udało mi się stworzyć ośrodek rozpoznawalny już na arenie międzynarodowej, że owocnie współpracujemy z innymi klinikami i zakładami w Centrum Onkologii-Instytucie. Jestem też dumna z zespołu OBWF, który udało mi się stworzyć, zespołu, który jest bardzo zaangażowany w swoje obowiązki, wyjątkowo profesjonalnie traktuje chorych, z cierpliwością odnosi się do różnych biurokratycznych aktywności. Razem jesteśmy w stanie przeprowadzić nawet najtrudniejsze badanie.
Pani Profesor, bardzo dziękuję za rozmowę.


Rozmawiał: Dariusz Olszewski,
Redaktor Naczelny, Badania Kliniczne
Staram się łączyć i jeden, i drugi obowiązek. Nie chciałbym być jedynie Prezesem Agencji zapominając przy tym o pacjentach i o medycynie. Myślę, że takie podejście pozwala uzyskać trochę inną, szerszą perspektywę. Jednocześnie łatwiej jest w ten sposób pamiętać o tym, co w życiu najważniejsze.
Już od dawna zajmowałem się problemami, które są powierzone Agencji. Od lat uczestniczyłem w wielu spotkaniach dotyczących europejskich regulacji badań klinicznych, brałem udział w pracach Europejskiej Rady Badań Klinicznych ds. Onkologii Dziecięcej, sam prowadziłem przez dwie kadencje dużą, międzynarodową grupę naukową, która zajmowała się badaniami klinicznymi dotyczącymi leczenia złośliwych nowotworów wątroby u dzieci. Miałem również okazję otworzyć polską gałąź bardzo dużego badania europejskiego, korzystając przy tym z funduszy europejskich z Programu Horizon 2020. Dlatego wiem ze swojego osobistego doświadczenia jak trudno otworzyć w Polsce niekomercyjne badanie kliniczne. Był to więc temat zawsze bliski mojemu sercu. Od wielu lat działam w tym obszarze i mam świadomość jak ważne jest to dla pacjentów.
Tak. Myślę, że można nawet sprecyzować ten obszar jako działania na rzecz rozwoju niekomercyjnych badań klinicznych, co jest przecież ustawowo głównym zadaniem Agencji.
To nie jest dla mnie nic nowego. Praktycznie od trzech lat pracuję w ten sposób. Jako kierownik Kliniki Chirurgii i Urologii Dzieci i Młodzieży Gdańskiego Uniwersytetu Medycznego wykonywałem równolegle obowiązki powierzane mi przez Prezydenta RP i przez Ministra Zdrowia. Nauczyłem się tak pracować, będąc członkiem Narodowej Rady Rozwoju, jak i odpowiadając za wiele projektów ministerialnych, po prostu musiałem to wszystko ze sobą godzić. Jednocześnie nie chcę odłożyć na bok chirurgii dziecięcej, ponieważ jest to dla mnie niezwykle ważna część życia.
Myślę, że to jest wielkie wyzwanie. Agencja tak naprawdę jeszcze się organizuje, jest młodą instytucją, dopiero został ogłoszony pierwszy konkurs na realizację niekomercyjnych badań klinicznych. To bardzo interesujące i ciekawe wyzwanie, dające jednocześnie więcej możliwości w porównaniu do wejścia do organizacji, która istnieje już od lat. Na tworzenie Agencji Badań Medycznych, jej kształt i charakter można mieć teraz znacznie większy wpływ. To ciekawsze, ale i inne wyzwanie, może nawet w pewnym sensie trudniejsze, niż wchodzenie do instytucji już zastanej, która ma swoje utrwalone nawyki i sposoby funkcjonowania. Oczywiście oznacza to, że przed nami jest jeszcze ogromna praca. Dopiero zaczynamy i choć wciąż ciężko pracujemy, to trzeba nam jeszcze dać trochę czasu. Mam nadzieję, że na koniec będziemy mogli pochwalić się wynikami. Teraz to są dopiero początki.
Chciałbym, żeby po tym czasie to była mocna organizacja z utrwaloną marką, nie tylko w Polsce. Zależy mi, aby to była instytucja, która jest rozpoznawalna i w polskich naukach medycznych, i zagranicą. Moją ambicją jest, żeby Agencja Badań Medycznych w Polsce miała taki brand jak Medical Research Council w Wielkiej Brytanii czy National Institutes of Health w Stanach Zjednoczonych. Pewnie, że marzyłbym o tym, aby dzięki naszemu wsparciu polska medycyna zasłużyła na swojego noblistę. Ale bądźmy realistami. Na to trzeba wielu lat pracy. Zakładam, że nie będziemy instytucją badawczą, choć pewne badania własne będziemy realizowali zgodnie z potrzebami polskiego systemu ochrony zdrowia, jak i Ministerstwa Zdrowia. Bardzo bym chciał, żeby liczba niekomercyjnych badań klinicznych w Polsce wzrosła i aby przyczyniło się to do poprawy dostępności nowych terapii dla polskich pacjentów, również nielekowych. Chciałbym, żebyśmy doprowadzili również do zmiany regulacji ustawowych w tym zakresie, bo pracując na gruncie europejskim miałem okazję przekonać się, jak ważny jest to obszar i jak czasem trudno przekonać decydentów, żeby zmienić zastane reguły prawa. Na poziomie europejskim to również nie było łatwe.
Na początek Agencja Badań Medycznych musi ugruntować swoją pozycję, stworzyć mechanizmy, które pozwolą jej należycie funkcjonować, np. stworzyć odpowiednie systemy elektroniczne, a także inne niezbędne narzędzia, w tym zbudować do końca odpowiedni zasób kadrowy i ekspercki. To jest dla mnie priorytet. Ustawa jako jedno z zadań Agencji zakłada również wspomaganie badań komercyjnych. Z pewnością będzie wymagało to zastanowienia się nad obraniem odpowiednich kierunków. Ze pewnością to, co w Polsce szwankuje to wspieranie nowych innowacyjnych technologii. Trzeba mieć świadomość, iż pomysły na nie powstają w start-up’ach i małych firmach. Dlatego trzeba zbudować odpowiedni system wsparcia dla nich. Jak dotąd, mimo wielu prób, średnio się to udaje. Jeżeli tego rodzaju badania będą odbywały się z korzyścią dla polskiego pacjenta, polskiej gospodarki lub będą stwarzały możliwości wprowadzenia większej innowacji, większej komercjalizacji produktów leczniczych wytworzonych w Polsce, to na pewno trzeba się nad tym pochylić. Pamiętajmy też, że mamy wiele mechanizmów i instytucji już działających: mamy NCBR, jest NCN, jest Polski Fundusz Rozwoju. Z kolei badania komercyjne już się toczą i wcale nie jest ich tak mało – choć moglibyśmy mieć więcej, gdybyśmy zbudowali odpowiednią sieć ośrodków badań klinicznych i poprawili otoczenie prawne. Chociaż mamy zatem tu zdecydowanie mniejszy problem, nie tak palący jak w przypadku badań niekomercyjnych, to i tak wiele zostaje do zrobienia.
Ja bym się tego nie obawiał. Badania komercyjne już są poddane rygorystycznym wymaganiom ustawodawcy, nie widzę powodu, aby te wymogi jeszcze bardziej zaostrzać. Na pewno jednak trzeba zadbać o interes pacjentów, w tym przede wszystkim kwestię ubezpieczeń. To będzie przedmiotem szerokich dyskusji, jeżeli chodzi o tę ustawę. Nasze pole manewru w tym zakresie jest jednak w pewnym sensie ograniczone, bo od kilku lat jest już wydane rozporządzenie unijne, a my musimy się po prostu do niego dostosować i zharmonizować nasze przepisy z europejskimi.
Zainteresowanie jest spore, nie ma jeszcze wpływu wniosków, bo to jest nadal trochę za wcześnie. Konkurs został dopiero otwarty, mamy czas do końca listopada, czyli wciąż około miesiąca jeszcze przed nami. Na podstawie różnego rodzaju spotkań, które odbyli pracownicy Agencji oraz wielu kontaktów ze środowiskiem akademickim spodziewam się, że spłynie wiele projektów. Zależy mi osobiście, jak i wszystkim nam w Agencji, żeby ten konkurs był udany.
Trzymania kciuków i modlitwy od tych, którzy wierzą w jej siłę.
Bardzo dziękuję za rozmowę!

W latach 2012-2014 był prezesem Polskiego Towarzystwa Chirurgów Dziecięcych, obecnie jest członkiem jego Zarządu Głównego. Przez dwie kolejne kadencje był przewodniczącym Międzynarodowej Grupy Strategicznej ds. Guzów Wątroby u Dzieci – SIOPEL. Obecnie pełni również funkcję prezesa Europejskiej Sekcji Chirurgów Dziecięcych Europejskiej Unii Specjalistów Medycznych (UEMS).
Zainteresowania naukowe prof. Czauderny obejmują przede wszystkim problem leczenia nowotworów, zwłaszcza guzów wątroby, oraz zastosowania wideochirurgii w chirurgii i onkologii dziecięcej. Brał udział w wielu krajowych i zagranicznych projektach naukowych jako wykonawca lub ich menedżer.
Jest współautorem podręczników polskich i zagranicznych oraz ponad 180 prac naukowych opublikowanych w najbardziej szanowanych czasopismach na świecie, m.in. New England Journal of Medicine, Lancet Oncology i Journal of Clinical Oncology. Całkowity wpływ jego publikacji wynosi ponad 400, podczas gdy liczba jego cytowań jest bliska 3000. Prowadził liczne krajowe i międzynarodowe kursy z zakresu chirurgii wideo i chirurgii onkologicznej. Regularnie pełnił funkcję recenzenta programów badawczych w Unii Europejskiej (7PR, Horyzont 2020).


Po przejściu wstępnego etapu rekrutacji nadchodzi moment na rozmowę z potencjalnym pracodawcą. Jest to zwykle najbardziej stresująca część całego procesu i wymagająca najwięcej przygotowania ze strony kandydata. Co zrobić, aby przejść przez rozmowę rekrutacyjną bez nerwów i zrobić dobre wrażenie na przyszłym pracodawcy?
Proces rekrutacji w każdej firmie opiera się mniej więcej na tym samym schemacie. Początkowe etapy nie są widoczne dla potencjalnego kandydata. Pracodawca, gdy podejmie decyzję o zatrudnieniu nowego pracownika, zaczyna proces od określenia kompetencji niezbędnych na dane stanowisko. W tym samym czasie powstaje lista oczekiwań wobec pracownika, dotycząca zarówno jego cech i umiejętności, jak i kwestii wynagrodzenia. Kolejnym etapem jest stworzenie ogłoszenia, które zobrazuje wszystkie kwalifikacje, jakimi powinien wykazać się kandydat, a także pokrótce przedstawi charakterystykę pracy oraz zadania czekające go na tym stanowisku.
Jako kandydaci nie mamy wpływu na te etapy procesu rekrutacji. Możemy jednak korzystać z wielu źródeł i znaleźć ogłoszenia, które nam odpowiadają zarówno pod względem proponowanych obowiązków, jak i własnych kompetencji i możliwości.
Pierwszym etapem, na który mamy realny wpływ podczas rekrutacji jest przygotowanie swojego CV. Warto przyłożyć się do tego zadania i napisać życiorys w sposób, który zwróci uwagę przyszłego pracodawcy/rekrutera na najważniejsze aspekty i mocne strony. Należy przy tym pamiętać, że większość firm kontaktuje się jedynie z wybranymi kandydatami, których przesłane dokumenty wystarczająco zainteresują osoby decyzyjne. Należy pamiętać, że w firmach zwykle nie ma czasu na przeglądanie wielostronicowego CV, dlatego warto się postarać, żeby kluczowe osiągnięcia pokazać w jak najbardziej przystępny sposób i skupić się tylko na aspektach, których oczekuje się od nowego pracownika.
Wybrani kandydaci zostają przez firmę zaproszeni na rozmowy rekrutacyjne. Jest to najbardziej znaczący etap w całym procesie, pozwalający w pełni zaprezentować się danemu kandydatowi.
Decyzje podejmowane są w firmie zazwyczaj po przeprowadzeniu szeregu rozmów rekrutacyjnych i w oparciu o pełną dokumentację kandydatów, taką jak: CV, list motywacyjny, referencje czy informacje uzyskane podczas spotkania. Dopiero po tym etapie kandydat może dostać odpowiedź i negocjować warunki zawarcia umowy.
Przed rozmową rekrutacyjną należy pamiętać o dobrym przygotowaniu. Odpowiedni research dotyczący stanowiska oraz firmy, do której aplikujemy, pozwoli nam na swobodną konwersację z pracodawcą. Znajomość historii oraz profilu firmy postawi nas w pozycji osoby chcącej świadomie brać udział w dalszym jej rozwoju. Warto również odświeżyć wiadomości z obszaru, którego dotyczy stanowisko, gdyż na rozmowie potencjalny pracodawca będzie chciał sprawdzić na ile CV kandydata zgadza się z jego  aktualną wiedzą. Mogą zostać przeprowadzane również testy, które pozwolą pracodawcy ocenić stan wiedzy przyszłego pracownika.
aktualną wiedzą. Mogą zostać przeprowadzane również testy, które pozwolą pracodawcy ocenić stan wiedzy przyszłego pracownika.
Zarówno w początkowym etapie aplikacji, jak i przy okazji samej rozmowy kwalifikacyjnej, warto skorzystać z porad ekspertów. Najważniejsze informacje możemy uzyskać z ogólnodostępnych źródeł, takich jak różnego rodzaje strony i poradniki internetowe. Pewności doda „przećwiczenie” rozmowy z rodziną czy znajomymi bądź z ekspertem zajmującym się rekrutacją, jeżeli tylko nadarzy się taka okazja. Kolejną wskazówką mogą być poradniki z zakresu autoprezentacji, które nie tylko pozwolą na zwiększenie świadomości naszej postawy, wypowiedzi czy mowy ciała, ale mogą dostarczyć przydatnych i praktycznych wskazówek. Przy wcześniejszych etapach rekrutacji, warto również skorzystać z możliwości udoskonalenia lub poprawienia swojego CV w oparciu o wiedzę specjalisty. Życiorys to pierwsza informacja, jaką otrzymuje rekruter na temat kandydata, dlatego powinien być on przemyślany i pokazywać przede wszystkim najmocniejsze cechy, przydatne na stanowisku, którego dotyczy rekrutacja. Taki Kącik CV dla absolwentów swoich szkoleń, od wielu lat prowadzi firma Soft Communication, gdzie ekspert pomaga rozwiać wątpliwości dotyczące swojego życiorysu zawodowego i wyeksponować obszary i doświadczenia, które mogą zainteresować potencjalnego pracodawcę.
Przygotowując się do rozmowy kwalifikacyjnej nie można zapomnieć o prezencji. Musimy być świadomi, że rekruter widzi nas po raz pierwszy. Z tego względu warto swoim wyglądem i zachowaniem zachęcić do współpracy.
Kandydat musi również pamiętać o przygotowaniu się na szereg pytań, które może zadać osoba prowadząca rozmowę, dotycząca zarówno jego doświadczenia, ambicji i przyszłych planów.
Przebieg spotkania rekrutacyjnego może wyglądać inaczej w każdej firmie i zależy on od specyfiki miejsca pracy oraz od stanowiska, na które kandydat aplikuje. Może ono (chociaż nie musi) zostać poprzedzone krótką, rekrutacyjną rozmową telefoniczną, w przypadku badań klinicznych – często w języku angielskim. Samo spotkanie może przybrać różne formy, o których kandydaci są zwykle uprzednio informowani. Możemy spodziewać się między innymi testów i zadań pozwalających na ocenę umiejętności niezbędnych w pracy na danym stanowisku, testów psychologicznych lub językowych czy zwykłej rozmowy z przedstawicielami firmy. Przyszły pracownik może również zostać poproszony o przygotowanie krótkiej prezentacji na temat swojego doświadczenia w branży. Rozmowy dotyczące stanowisk dotykających obszaru badań klinicznych są bardzo często przeprowadzane w języku angielskim, co pozwala na ustalenie komunikatywności kandydata w tzw. języku badań klinicznych.
Rozmowa kwalifikacyjna jest najbardziej stresującym etapem szukania pracy. Pamiętaj, że twój przyszły pracodawca też był kiedyś na twoim miejscu i wie z czym wiąże się przygotowanie do spotkania rekrutacyjnego. Warto zdać sobie sprawę, że jest to etap, na który, jako kandydaci, mamy największy wpływ. Dobre przegotowanie do spotkania pozwoli na przedstawienie się z najlepszej strony i zwiększy szanse na sukces.
 Jako certyfikowany trener zarządza strategią i nadzoruje rozwój inicjatywy szkoleniowej Akademia Badań Klinicznych. Absolwentka Wydziałów Lekarskiego i Farmaceutycznego Akademii Medycznej. Wiele lat budowała korporacyjne zespoły sprzedaży w międzynarodowych firmach. Z sukcesem wprowadzała na rynek nowe produkty w różnych grupach terapeutycznych (urologia, onkologia, gastroenterologia) i odpowiadała za strategię ich rozwoju. Wiedza medyczna i z zakresu farmacji pozwala jej na skuteczne podejmowanie działań w projektach badawczych, między innymi tworzeniu protokołów, zarządzaniu i nadzorowaniu badań. Jest czynnym członkiem Stowarzyszenia na Rzecz Dobrej Praktyki Badań Klinicznych GCPpl.
Jako certyfikowany trener zarządza strategią i nadzoruje rozwój inicjatywy szkoleniowej Akademia Badań Klinicznych. Absolwentka Wydziałów Lekarskiego i Farmaceutycznego Akademii Medycznej. Wiele lat budowała korporacyjne zespoły sprzedaży w międzynarodowych firmach. Z sukcesem wprowadzała na rynek nowe produkty w różnych grupach terapeutycznych (urologia, onkologia, gastroenterologia) i odpowiadała za strategię ich rozwoju. Wiedza medyczna i z zakresu farmacji pozwala jej na skuteczne podejmowanie działań w projektach badawczych, między innymi tworzeniu protokołów, zarządzaniu i nadzorowaniu badań. Jest czynnym członkiem Stowarzyszenia na Rzecz Dobrej Praktyki Badań Klinicznych GCPpl.
Kierowana przez nią firma Soft Communication oferuje niszowe usługi wspierania programów badawczych, naukowych i badań klinicznych wyrobów medycznych i produktów leczniczych w różnych zakresach i fazach. Dzięki tym działaniom zdobyła unikalne doświadczenie w prowadzeniu projektów wymagających nieszablonowego podejścia, wielkiego zaangażowania i zdolności negocjacyjnych z pogranicza medycyny, farmacji i biznesu.
Jest nastawioną na potrzeby klienta entuzjastką kompromisowych rozwiązań (win-win).
© 2022 Wszystkie prawa zastrzeżone