
Rozmawiał: Dariusz Olszewski,
Redaktor Naczelny, Badania Kliniczne
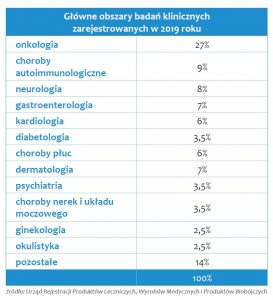
W zeszłym roku informowałem, że rezygnacja z konieczności składania wraz z wnioskiem o rozpoczęcie badania klinicznego umów zawieranych pomiędzy sponsorem a badaczem i ośrodkiem badawczym wpłynęła korzystnie na liczbę wpływających wniosków. W tym roku mogę potwierdzić, że nie była to chwilowa tendencja – w 2019 roku otrzymaliśmy niewiele mniej wniosków niż w 2018 roku (jak dotąd rekordowym). Do Centralnej Ewidencji Badań Klinicznych wpisaliśmy aż 603 badania – to nowy rekord zarejestrowanych w danym roku badań. Jak co roku największa liczba wniosków o rozpoczęcie badania klinicznego dotyczyła onkologii – 27% wniosków. Inne obszary medycyny, dla których w 2019 otrzymaliśmy najwięcej wniosków o rozpoczęcie badania klinicznego to choroby autoimmunologiczne (9%), neurologia (ponad 8%), gastroenterologia (7%), dermatologia (7), kardiologia (6%) i choroby płuc (6%). W 2019 roku wzrosła do 9% liczba badań prowadzonych z udziałem populacji pediatrycznej (w 2018 roku było to 6,5% badań, w 2017 roku – 5%). Onkologia, choroby autoimmunologiczne i neurologia – tych obszarów dotyczyła największa liczba badań klinicznych rejestrowanych w ostatnich latach.
W odniesieniu do faz zgłaszanych do Urzędu badań, jak co roku najwięcej wniosków o rozpoczęcie badania klinicznego dotyczyło fazy III – 52% i II – 32%. Zaobserwowaliśmy wzrost liczby badań zgłaszanych jako faza I – w 2019 roku aż 12% wniosków złożonych stanowiły badania I fazy. Około 4% stanowiły badania porejestracyjne 4 fazy.
Trudno mi powiedzieć czy widoczne są różnice w badaniach prowadzonych i rejestrowanych w poszczególnych krajach europejskich, nie prowadzimy takich analiz. Z całą pewnością w wielu krajach europejskich rejestruje się znacznie więcej badań niekomercyjnych.
Temat badań niekomercyjnych w Polsce był szeroko omawiany w zeszłym roku w związku z powstaniem Agencji Badań Medycznych. Mamy nadzieję, że dzięki finansowaniu ABM liczba badań prowadzonych przez sponsorów niekomercyjnych znacznie wzrośnie w najbliższych latach. Jeżeli chodzi o liczbę wniosków o rozpoczęcie badania klinicznego składanych w poszczególnych krajach Unii Europejskiej to, biorąc pod uwagę dane z europejskiej bazy badań klinicznych EudraCT, Polska plasuje się 6 miejscu: po Hiszpanii, Niemczech, Wielkiej Brytanii, Francji i Holandii.
Liczba pacjentów zadeklarowana we wnioskach o rozpoczęcie badania klinicznego złożonych w 2019 roku to ponad 30 000 osób.
Im więcej badań rejestrujemy tym więcej badań się toczy. W zeszłym roku w Centralnej Ewidencji Badań Klinicznych było ponad 2000 niezakończonych badań klinicznych.
Rocznie otrzymujemy kilkanaście wniosków o rozpoczęcie badania klinicznego sponsorowanych przez polskie firmy – w dużej mierze wnioski te dotyczą biorównoważności; wnioski dotyczące innowacyjnych rozwiązań, nowych cząsteczek zdarzają się rzadko – w ostatnich latach pojawiają się częściej – nadal są to jednak pojedyncze przypadki. Nie są to zaskakujące dane – od lat mówi się w Polsce o konieczności wzmacniania i rozwoju potencjału naukowego oraz potencjału krajowego sektora farmaceutycznego tak, aby to Polska była źródłem innowacyjnych leków.
Niestety nie zaobserwowaliśmy wzrostu liczby wniosków sponsorów niekomercyjnych. Najwyższa liczba takich wniosków – 24 – wpłynęła do Urzędu w 2017 roku. W 2018 roku było to 18 wniosków, a w 2019 – tylko 16. Oczekujemy na wyniki pierwszego konkursu ogłoszonego w 2019 roku przez ABM i liczymy na to, że oferowane przez Agencję finansowanie podniesie znacząco liczbę badań klinicznych niekomercyjnych.
Mogę potwierdzić, że trafiają do Urzędu protokoły badań proponujące innowacyjne rozwiązania, dotyczą one oczywiście badań prowadzonych w onkologii. Obszar farmakoterapii w onkologii to miejsce szczególnie ukierunkowane na badania nowoczesnych, nowatorskich leków, których rozwój budzi nadzieję na znalezienie skuteczniejszego oręża w nadal nierównej walce z nowotworami złośliwymi. Nowe rozwiązania są efektem zmiany w podejściu do charakteryzowania chorób i procesu leczenia czyli medycyny personalizowanej. Medycyna personalizowana opiera się na przekonaniu, że rozwój choroby, jej przebieg i odpowiedź na leczenie są procesami bardzo zróżnicowanymi, które mogą przebiegać odmiennie u różnych pacjentów, a choroba każdej osoby może być wyjątkowa i z tego względu potrzebne jest indywidualne podejście. Medycyna personalizowana, dzięki precyzyjnym narzędziom pozwala dobrać odpowiednie leczenie do konkretnego pacjenta w odpowiednim czasie. W związku z tym w sposobie rozwoju leków również zachodzą duże zmiany, toczą się dyskusje na temat przyszłości metodologii badań klinicznych, pojawiają się propozycje modyfikacji tradycyjnego podziału badań klinicznych na badania fazy I, II, i III. Oprócz znanych już od lat badań adaptacyjnych – badań w układzie elastycznym, w którym przeprowadza się analizy pośrednie i na tej podstawie wprowadza się modyfikacje do początkowego projektu, pojawiły się projekty badań parasolowych „umbrella trials” lub koszykowych „basket trials”. W tych pierwszych badany jest wpływ różnych produktów stosowanych w pojedynczym rodzaju nowotworu, natomiast w badaniach koszykowych odwraca się ten schemat i bada się wybrany produkt leczniczy w wielu rodzajach nowotworu (lub w różnych chorobach o wspólnym podłożu). Elastyczne podejście umożliwia uzyskanie większej ilości danych w krótszym czasie i tym samym może skrócić całkowity czas rozwoju produktu. Innowacyjne propozycje mogą umożliwić wcześniejsze zidentyfikowanie nieskutecznych badanych produktów i pozwolą na przesunięcie zasobów na bardziej obiecujące metody leczenia. Niewątpliwie jednak proces oceny nowatorskich protokołów jest dużo trudniejszy, właściwie są dopiero wypracowywane schematy oceny. Z perspektywy organu kompetentnego odejście od klasycznych modeli badań klinicznych wymaga przemodelowania tradycyjnych schematów oceny dokumentacji badania. Należy również pamiętać o ryzyku związanym z samym prowadzeniem badania, jego nadzorem i monitorowaniem w sytuacji, gdy w jednym badaniu mamy np. odrębne kryteria włączenia i wyłączenia dla kilku grup pacjentów. Badania tego typu powinny być projektowane i prowadzone przez wyspecjalizowane ośrodki, zapewniając odpowiednie bezpieczeństwo uczestnikom badań, dbając jednocześnie o jakość uzyskiwanych wyników.
Pracownicy Urzędu zostali wyznaczeni przez Ministra Zdrowia jako członkowie zespołu, który pod kierunkiem ABM przygotowywał projekt ustawy o badaniach klinicznych. Nasi przedstawicie brali udział w pracach plenarnych, jak również w pracach podgrup, skupiających się już na konkretnych tematach. Rolą Urzędu było przygotowanie części kompetencyjnej ustawy, dotyczącej postępowania w przedmiocie wydania pozwolenia na badanie kliniczne i, istotną zmianę, propozycji opłat oraz części dotyczącej inspekcji badań klinicznych. Chciałbym zwrócić uwagę, że zmiany w postępowaniu w przedmiocie wydania pozwolenia na badanie kliniczne w zakresie terminów, rodzaju składanej dokumentacji oraz zakresu oceny, wprowadziło Rozporządzenie 536/2014. Tam znajdują się innowacyjne rozwiązania, na które czekamy, takie jak portal i baza danych badań klinicznych.

W projektowanej ustawie o badaniach klinicznych najistotniejszą dla Urzędu częścią jest bez wątpienia część dotycząca organizacji komisji bioetycznych oraz proces wydawania opinii przez komisje – pamiętajmy, że organ kompetentny będzie musiał wydać jedną decyzję w państwie członkowskim; decyzja ta będzie wynikiem wspólnej etycznej i merytorycznej oceny dokumentacji badania klinicznego. Podstawą wypełnienia założeń Rozporządzenia 536/2014 będzie sprawna komunikacja pomiędzy komisją etyczną i organem właściwym dla wydawania decyzji odnośnie możliwości prowadzenia badania klinicznego. Ważnym tematem jest również ustanowienie systemów odszkodowawczych oraz określenie wymiaru odszkodowania i kary w przypadku szkody wyrządzonej uczestnikowi badania klinicznego. Obecnie zastosowany system odpowiedzialności cywilnej badacza i sponsora budzi wiele zastrzeżeń ponieważ w praktyce uniemożliwia uzyskanie odszkodowania przez uczestników badań klinicznych. Zaproponowane w ustawie rozwiązanie oparte na Funduszu gwarancyjnym oraz ubezpieczeniu OC badacza i sponsora powinno zmienić tę niekorzystną dla uczestników badań klinicznych sytuację.
Zgodnie z projektem Ustawy o badaniach klinicznych, który został przekazany do Ministerstwa Zdrowia organem właściwym do prowadzenia określonych w ustawie postępowania w zakresie badań klinicznych produktów leczniczych (m. in. wydania pozwolenia na badanie i zmianę istotną, cofnięcia lub zawieszenia badania klinicznego) będzie Prezes Urzędu Rejestracji PLWMiPB. Tak jak wspomniałem wcześniej Rozporządzenie 536/2014, na podstawie którego będziemy pracować w niedalekiej przyszłości wprowadza nowe warunki, wymagania, terminy zarówno dla organów kompetentnych, jak i dla sponsorów badań klinicznych. Niewątpliwie będzie to szansa na zniwelowanie wielu barier, jakie istnieją obecnie, ale jednocześnie będzie to dla nas wszystkich spore wyzwanie. Rolą rozporządzenia jest stworzenie warunków do prowadzenia badań klinicznych w UE z zachowaniem najwyższych standardów bezpieczeństwa uczestników badań. Celem wprowadzenia nowych przepisów jest również wzrost transparentności danych dotyczących badań klinicznych prowadzonych w UE. Przepisy wprowadzone przez Rozporządzenie pozwolą na uniknięcie wielokrotnego oceniania dokumentacji. Rozporządzenie wprowadza m.in.:
Każde zainteresowane państwo członkowskie będzie powiadamiać sponsora za pośrednictwem portalu UE, czy wydaje pozwolenie na badanie kliniczne, czy wydaje je pod pewnymi warunkami, czy też odmawia wydania pozwolenia. Powiadomienie będzie się odbywać w drodze jednej decyzji, badanie wymagać będzie jednak zarówno oceny naukowej, jak i etycznej. Przepisy Rozporządzenia pozwolą na harmonizację przepisów administracyjnych regulujących badania kliniczne i ograniczą do minimum różnice w podejściu do rejestracji badań klinicznych między państwami członkowskimi.
Od roku 2016, kiedy to Wielka Brytania podjęła decyzję o opuszczeniu struktur europejskich, trwa proces BREXIT-u, uruchomiony przez art. 50 Traktatu o Unii Europejskiej. Plany wyjścia Zjednoczonego Królestwa ze wspólnoty w szczególny sposób dotknęły Europejską Agencję Leków (EMA), gdzie zasiadam w Grupie Koordynatorów ds. Budżetu i Programu Prac. W minionym, 2019 roku doszło do finalizacji przenosin siedziby Agencji do Amsterdamu, procesu przygotowywanego od 2018 roku na poziomie Rady Zarządzającej. Przenosiny Agencji były jednym z największych wyzwań, nie tylko ze względu na techniczny aspekt związany z przeprowadzeniem ok. 900 osobowej instytucji do innego kraju, ale również ze względu na cały szereg implikacji, takich jak utrudnienia i ograniczenia w płynności realizacji wszystkich zadań Agencji, czy też problem utraty personelu, szacowany na ponad 20% stanu. Szerokie spectrum dotyczące spraw związanych z BREXIT-em uzupełnił w minionym roku także problem dostępności produktów leczniczych przeznaczonych dla ludzi i zwierząt. W tym kontekście EMA podjęła działania mające na celu zminimalizowanie skali problemu, m.in. za sprawą monitorowania i weryfikowania dostępności newralgicznych produktów leczniczych z wykorzystaniem systemów bazodanowych, a także, ze strony Urzędu, jako jednej z europejskich agencji, opiniowanie wniosków podmiotów odpowiedzialnych dotyczących wyrażania zgody na prolongatę terminu uznawania wyników badań w zakresie kontroli serii gotowego produktu leczniczego do końca 2019 r. Działania te realizowane były lub nadal są realizowane w związku z koniecznością przeniesienia tych miejsc z terytorium Wielkiej Brytanii do pozostałych państw członkowskich lub krajów objętych umową MRA. Mając na względzie niezwykłą rolę realizowanych zadań dotyczących wystąpienia Wielkiej Brytanii z UE, Urząd prowadzi na swojej stronie internetowej zakładkę „BREXIT”, gdzie zamieszczane są istotne informacje w tej tematyce wraz z przewodnikami postępowania, oraz często zadawanymi pytaniami i odpowiedziami dla produktów rejestrowanych centralnie, jak również w procedurach europejskich.
W dalszym ciągu czekamy na ostateczny terminarz dotyczącego ogłoszenia funkcjonalności portalu i bazy danych badań klinicznych, które na potrzeby Rozporządzenia 536/2014 buduje Europejska Agencja Leków. W grudniu 2019 r. Zarząd EMA zatwierdził rozpoczęcie audytu systemu w grudniu 2020 roku, oczywiście po ocenie gotowości do audytu przeprowadzonej przez wyznaczonych właścicieli produktów, EMA i dostawcę IT.
Z całą pewnością czekają nas jeszcze prace w zakresie projektu ustawy, na etapie konsultacji wewnętrznych jest jeszcze kilka tematów, które wymagają dopracowania. Konsultacje społeczne projektu również mogą przynieść wiele cennych uwag co do wypracowanych propozycji. Wyzwaniem jest przygotowanie do wspólnej oceny merytorycznej pod przewodnictwem państwa sprawozdawcy w ramach Rozporządzenia 536/14. Wspólna ocena wymaga wypracowania wspólnych zasad i zakresu wymagań. Musimy również przygotować naszych ekspertów do podjęcia roli sprawozdawcy. Taka ocena wymaga nie tylko wiedzy i doświadczenia w ocenianym badaniu, ale również umiejętności dyskusji i wypracowywania wspólnego stanowiska w międzynarodowym środowisku. Rozporządzenie 536/2014 wprowadzi również współpracę państw członkowskich przy ocenie sprawozdań dotyczących bezpieczeństwa badanych produktów leczniczych. W tym zakresie również musimy zdobyć potrzebne doświadczenie, potrzebujemy także odpowiedniej kadry ekspertów.
 Prezes Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Absolwent Wydziału Farmaceutycznego Akademii Medycznej w Warszawie o specjalizacji technologia przemysłowa. Doktor nauk o zdrowiu w dziedzinie farmakologii na I Wydziale Lekarskim Warszawskiego Uniwersytetu Medycznego. W latach 2001-2002 pracownik Instytutu Leków w Warszawie. Z Urzędem jest związany nieprzerwanie od czasu jego powstania. Był m.in. bezpośrednio odpowiedzialny za przeprowadzone w latach 2004- 2008 dostosowanie dokumentacji produktów leczniczych do wymogów prawa europejskiego, zgodnie z Traktatem o Przystąpieniu Rzeczypospolitej Polskiej do Unii Europejskiej. Od 2010 r. członek Rady Zarządzającej Europejskiej Agencji Leków (EMA), a od 2016 r. Wiceprzewodniczący Rady. Od 2012 r. jest jednym z trzech członków działającej w ramach Rady Zarządzającej Grupy Koordynacyjnej do Spraw Budżetu i Programu Prac EMA. Został również wybrany na Mentora Emacolex – Grupy Roboczej Prawników Agencji Leków Unii Europejskiej i Europejskiego Obszaru Gospodarczego. Uczestnicząc w sieci Szefów Agencji Leków Unii Europejskiej i Europejskiego Obszaru Gospodarczego koncentruje swoje działania na zapewnieniu harmonijnej współpracy narodowych agencji regulacyjnych w ramach przyjętej przez te agencje wspólnej strategii działania w zakresie dopuszczania do obrotu i monitorowania bezpieczeństwa stosowania produktów leczniczych.
Prezes Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Absolwent Wydziału Farmaceutycznego Akademii Medycznej w Warszawie o specjalizacji technologia przemysłowa. Doktor nauk o zdrowiu w dziedzinie farmakologii na I Wydziale Lekarskim Warszawskiego Uniwersytetu Medycznego. W latach 2001-2002 pracownik Instytutu Leków w Warszawie. Z Urzędem jest związany nieprzerwanie od czasu jego powstania. Był m.in. bezpośrednio odpowiedzialny za przeprowadzone w latach 2004- 2008 dostosowanie dokumentacji produktów leczniczych do wymogów prawa europejskiego, zgodnie z Traktatem o Przystąpieniu Rzeczypospolitej Polskiej do Unii Europejskiej. Od 2010 r. członek Rady Zarządzającej Europejskiej Agencji Leków (EMA), a od 2016 r. Wiceprzewodniczący Rady. Od 2012 r. jest jednym z trzech członków działającej w ramach Rady Zarządzającej Grupy Koordynacyjnej do Spraw Budżetu i Programu Prac EMA. Został również wybrany na Mentora Emacolex – Grupy Roboczej Prawników Agencji Leków Unii Europejskiej i Europejskiego Obszaru Gospodarczego. Uczestnicząc w sieci Szefów Agencji Leków Unii Europejskiej i Europejskiego Obszaru Gospodarczego koncentruje swoje działania na zapewnieniu harmonijnej współpracy narodowych agencji regulacyjnych w ramach przyjętej przez te agencje wspólnej strategii działania w zakresie dopuszczania do obrotu i monitorowania bezpieczeństwa stosowania produktów leczniczych.
© 2022 Wszystkie prawa zastrzeżone