



W opinii organizacji branżowych POLCRO, GCPpl oraz INFARMA, pandemia wirusa SARS-CoV-2019 jest bardzo poważnym zdarzeniem, który wpływa na bezpieczeństwo uczestników badania klinicznego, a sponsor i badacz mają obowiązek rozważyć wszelkie ryzyka i zastosować odpowiednie środki w celu zapewnienia bezpieczeństwa uczestnikom badania klinicznego.
Dlatego też organizacje opracowały dokument „Dobre praktyki badań klinicznych w trakcie trwania epidemii COVID-19” (uaktualniona wersja 2.0 dokumentu z dnia 15 kwietnia 2020 oraz jej tłumaczenie na język angielski), który zawiera proponowane dobre praktyki i możliwe rozwiązania, które można rozważyć i dostosować do każdego badania klinicznego (komercyjnego i niekomercyjnego) w celu wyeliminowania ryzyka. Część z przedstawionych rekomendacji istnieje już jako rozwiązania wprowadzone przez Sponsorów, Ośrodki czy Komisje Bioetyczne. Dokument będzie podlegał modyfikacjom, zależnie od pojawienia się kolejnych rekomendacji, komunikatów i uwag ze strony URPL, Komisji Bioetycznych, Ministerstwa Zdrowia, oraz innych instytucji i podmiotów zaangażowanych w prowadzenie badań klinicznych.


Firma PPD poinformowała, iż należąca do niej spółka Accelerated Enrollment Solutions (AES) zawarła umowę z Science 37, liderem w zakresie zdalnego prowadzenia badań klinicznych, o współpracy w obszarze rekrutacji oraz włączania do badań klinicznych uczestników, którzy mieszkają poza zasięgiem tradycyjnych ośrodków badań klinicznych. Firmy pracują również nad rozwiązaniami mającymi zapewnić ciągłości badań klinicznych, na przebieg których wpływ wywarła obecna pandemia COVID-19. Rozwiązania te obejmują między innymi wykorzystanie telemedycyny do zdalnego screeningu oraz wirtualnych wizyt pacjentów uczestniczących w badaniu.
Współpraca pozwoli firmie AES dostarczać swym klientom rozwiązania zwiększające dostępność do pacjentów dzięki wyjściu poza swą obecną, fizyczną infrastrukturę ponad 180 ośrodków. Zamiast tego pacjenci mogą uczestniczyć w prowadzonych przez AES badaniach dzięki rozwiązaniu Metasite™ firmy Science 37, metodologii hybrydowych badań klinicznych, która łączy tradycyjne wizyty w ośrodkach z rozwiązaniami interakcji zdalnych, co pozwala uczestniczyć w badaniu pacjentom mieszkającym praktycznie w dowolnej lokalizacji geograficznej. Dzięki umowie Science 37 zyska dostęp do globalnej sieci badawczej stworzonej przez AES. Wspólnie obie firmy będą w stanie zaoferować różnorodne połączenia wizyt tradycyjnych z wirtualnymi, co pozwoli prowadzić badania na całym świecie, gdzie w centrum uwagi znajdzie się pacjent.
– Cieszymy się, że dzięki współpracy z Science 37 będziemy mogli zapewnić naszym klientom najbardziej zaawansowane, sprawdzone podejście do wirtualizacji badań klinicznych – powiedział Roger Smith, dyrektor generalny w AES. – Dzięki ofercie stworzonego przez Science 37 rozwiązania Metasite, w połączeniu z naszą obecną siecią ośrodków, umożliwiamy naszym klientom skok w przyszłość, w której większa liczba pacjentów zyska możliwość uczestnictwa w badaniach, które w innym przypadku nie byłyby dla nich dostępne z powodu ograniczeń geograficznych.
Poza zarządzaniem globalną siecią ośrodków, AES zapewnia startup, enrollment pacjentów, czy prowadzenie badań w ramach pojedynczego kontraktu za pośrednictwem scentralizowanych i kontrolowanych procesów. Równolegle, Science 37 nadzoruje szeroką sieć badaczy stosujących rozwiązania telemedycyny, pielęgniarek pracujących w trybie in-home oraz koordynatorów badań klinicznych, którzy są połączeni za pośrednictwem dedykowanej, zintegrowanej platformy wspierającej organizację wirtualnych badań klinicznych, znanych również jako zdecentralizowane badania kliniczne (eng. decentralized clinical trias).
– Science 37 znana jest w Stanach Zjednoczonych ze swych zdolności prowadzenia w pełni zdecentralizowanych badań klinicznych – powiedział David Coman, CEO w Science 37. – Teraz, dzięki połączeniu z globalnym zasięgiem firmy AES, wypełniamy naszą obietnicę „stworzenia nowej rzeczywistości dzięki wirtualności” niemal w każdym zakątku świata.
Jednocześnie obie firmy mobilizują swoje zasoby i przyłączają się do walki z pandemią COVID-19. Skupi się ona na wsparciu obecnie toczących się badań klinicznych w zakresie utrzymania odpowiednich poziomów włączania pacjentów oraz prowadzenia badań z wykorzystaniem telemedycyny, a także usprawnienia rozwiązań hybrydowych – fizycznych/wirtualnych – w celu umożliwienia szybkiej rekrutacji i włączania pacjentów do badań nad szczepionką przeciw COVID-19.


Utworzony na mocy specustawy fundusz znacząco usprawni m.in. proces finansowania projektów badawczych, co ma doprowadzić do szybszego opracowania skutecznych metod diagnostyki i leczenia koronawirusa.
– Dzięki tym rozwiązaniom możemy działać szybko i sprawnie, a czas gra tutaj niebagatelną rolę! Im szybciej naukowcy otrzymają dofinasowanie i rozpoczną pracę, tym prędzej owoce tych działań trafią do pacjentów. To obecnie nasz kluczowy priorytet – tłumaczy dr n. med. Radosław Sierpiński, prezes Agencji Badań Medycznych.
Jak podkreśla prezes ABM, dofinansowanie w wysokości nawet 5 mln zł otrzyma każdy projekt o dużym potencjale naukowym, który może przyczynić się do opracowania szybkiego testu diagnostycznego, szczepionki lub skutecznych metod terapii koronawirusa.
Szczególnie istotny jest krótki czas oczekiwania na wstępną decyzję o finansowaniu, wynoszący zaledwie 72 godziny. Projekty przyjmowane są w trybie ciągłym. Jak podkreśla Agencja Badań Medycznych: w zależności od potrzeb dostępna pula środków może być zwiększona.
Agencja umożliwi sfinansowanie 100% kosztów prac badawczo–rozwojowych.
O dofinansowanie mogą ubiegać się m.in.: uczelnie medyczne, federacje podmiotów systemu szkolnictwa wyższego i nauki, Polska Akademia Nauk, instytuty naukowe PAN, instytuty badawcze, przedsiębiorcy mający status centrum badawczo-rozwojowego międzynarodowe instytuty naukowe oraz inne podmioty prowadzące głównie działalność naukową w sposób samodzielny i ciągły.
Jednocześnie Agencja Badań Medycznych rozpoczęła badanie własne pn. „Badania nad szczepionką przeciwko wirusowi SARS-CoV-2 oraz wsparciu prac badawczych nad poszukiwaniem skutecznej terapii”.
Projekt realizowany jest w partnerstwie z polskimi i międzynarodowymi ośrodkami – Siecią Badawczą Łukasiewicz, Instytutem Biotechnologii i Antybiotyków wraz z zespołem prof. Marcina Drąga z Politechniki Wrocławskiej, Narodowym Instytutem Onkologii w konsorcjum z Instytutem Biochemii i Biofizyki PAN i Warszawskim Uniwersytetem Medycznym oraz Uniwersytetem Medycznym we Wrocławiu.
– Włączamy się w międzynarodowe działania w walce z koronawirusem, realizaując w naszym kraju projekty na światowym poziomie. Jestem przekonany, że polskie koncepty okażą się sukcesem i wkrótce będziemy mogli skorzystać z efektów ich pracy – podsumowuje Radosław Sierpiński, prezes ABM.


W związku z przyjęciem Polski do Europejskiej Sieci Infrastruktury ds. badań Klinicznych (ECRIN) z dniem 23 sierpnia 2019 r., na okres trzech lat w charakterze obserwatora, Agencja Badań Medycznych utworzyła jednostkę POLCRIN (eng. Polish Clinical Research Infrastructure Network).
W związku z powołaniem Sieci, Agencja Badań Medycznych uruchomiła do dyspozycji polskich badaczy oraz ich zespołów stronę internetową organizacji: https://polcrin.abm.gov.pl/. Strona przekazuje informacje o sieci POLCRIN, jak również rzetelne treści wspomagające prowadzenie niekomercyjnych badań klinicznych.
POLCRIN (Polish Clinical Reasearch Infrastructure Network) to krajowa sieć ośrodków prowadzących badania kliniczne produktów leczniczych i wyrobów medycznych, będąca częścią ogólnoeuropejskiej sieci ECRIN – Europejska Sieć Infrastruktur Badań Klinicznych, (ang. European Clinical Research Infrastructure Network). Sieć ECRIN jest organizacją typu non-profit, która powstała, aby promować i ułatwiać prowadzenie międzynarodowych badań klinicznych na naszym kontynencie. Działalność organizacji skupia się na badaniach klinicznych zainicjowanych przez sponsorów akademickich.
– Sieć ECRIN umożliwia międzynarodową niekomercyjnych badań klinicznych. Dotychczas Polska na mapie takich przedsięwzięć była, niestety, białą plamą. Dzisiaj to zmieniamy. Dzięki przystąpieniu naszego kraju do sieci i powołaniu jednostki POLCRIN, polscy pacjenci będą mogli stać się uczestnikami dużych międzynarodowych badań klinicznych, a tym samym korzystać z najnowszych terapii, bez konieczności wyjeżdżania z kraju – podkreśla Prezes Agencji Badań Medycznych – dr n.med. Radosław Sierpiński.
Instytucją reprezentującą nasz kraj w ECRIN została Agencja Badań Medycznych. W związku z dołączeniem do Sieci, Prezes ABM dr n. med. Radosław Sierpiński powołał jednostkę POLCRIN, która tak jak Słowacja i Szwajcaria uzyskała status obserwatora ECRIN. Status członka organizacji posiadają natomiast Czechy, Francja, Hiszpania, Irlandia, Niemcy, Norwegia, Węgry, Włochy oraz Portugalia.
Wielu badaczy i sponsorów niekomercyjnych badań klinicznych nie bierze udziału w badaniach międzynarodowych, obawiając się różnych barier formalnych, czy logistycznych (np. spełnienia różnych wymogów prawnych poszczególnych krajów, konieczności mnogiej oceny bioetycznej, kwestii zarządzania badaniem i jego finansami). W efekcie badania niekomercyjne ciągle częściej przeprowadza się w jednym tylko kraju w porównaniu z badaniami sponsorowanymi przez podmioty komercyjne (np. firmy farmaceutyczne). Zadaniem POLCRIN jest wsparcie badaczy w pokonywaniu powyższych przeszkód .
Jak mówi Dyrektor Instytutu „Pomnik – Centrum Zdrowia Dziecka” – Koordynator Krajowy ds. Badań Pediatrycznych w POLCRIN – dr n. med. Marek Migdał: –Utworzenie przez ABM infrastruktury POLCRIN daje szansę na zwiększenie liczby prowadzonych w Polsce międzynarodowych, wieloośrodkowych badań klinicznych przyszłych produktów leczniczych. Poprzez POLCRIN polskie ośrodki badawcze będą mogły być włączone w dobrze zorganizowane struktury badawcze działające w 12 europejskich krajach. Wspólne działanie daje szanse na szybsze prowadzenie badań klinicznych z zapewnieniem najwyższej jakości ich prowadzenia. W chwili obecnej to także szansa na szybkie włączenie polskich ośrodków do badań dotyczących leków przeciwwirusowych, czy szczepionek mogących pomóc w zwalczaniu pandemii wywołanej SARS-CoV-2.
Celem nadrzędnym POLCRIN jest wzrost ilości niekomercyjnych badań klinicznych w Polsce o charakterze międzynarodowym, pamiętając o potencjale naszych badaczy, a także o korzyściach wynikających ze współpracy międzynarodowej. W związku z powyższym uruchomiony został portal https://polcrin.abm.gov.pl/

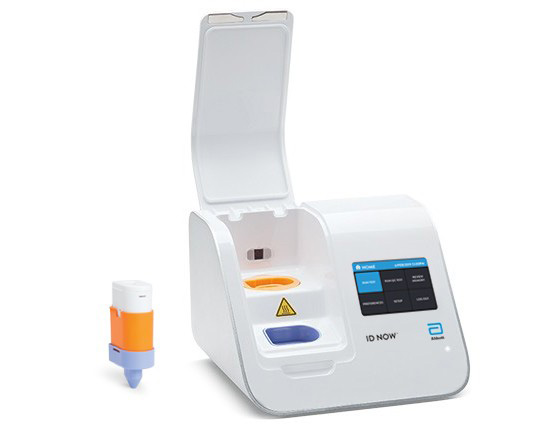
To, co wyróżnia ten test spośród innych, to fakt, że może być on wykorzystany nie tylko w warunkach szpitalnych, ale w każdym gabinecie lekarskim, czy w izbach przyjęć pacjentów.
Opracowany przez Abbott nowy test ID NOW COVID-19 współpracuje z platformą ID NOWTM – niewielkim urządzeniem wielkości tostera, które może być stosowane praktycznie w każdym miejscu.
Dzięki niewielkim rozmiarom urządzenia, testy mogą być wykonywane w dowolnym miejscu, co stanowi alternatywną technologię do walki z koronawirusem, dając pacjentom wyniki w zaledwie kilka minut.
Począwszy od 30 marca 2020 r. Abbott planuje rozpocząć produkcję nowych testów ID NOW COVID-19 w tempie 50 000 sztuk dziennie, które niezwłocznie trafią do amerykańskiego systemu opieki zdrowotnej.
Wykonywanie testów pozostaje jednym z najważniejszych elementów kontroli pandemii COVID-19. Stąd zaopatrywanie profesjonalistów służby zdrowia w nowe technologie pomagające zahamować rozprzestrzenianie się zakażeń stanowi najwyższy priorytet zarówno dla władz, jak i profesjonalistów służby zdrowia.
– Dzięki niewiarygodnej pracy zespołów firmy Abbott, planujemy dostarczać 50 tys. testów ID NOW COVID-19 dziennie profesjonalistom służby zdrowia działającym na pierwszej linii frontu, gdzie możliwość szybkiego wykonania testu jest potrzebna najbardziej – powiedział Chris Scoggins, prezes dywizji Rapid Diagnostics, Abbott. – Przenośne testy molekularne zwiększają zdolności Państwa do udzielania odpowiedzi na bieżące pytania ze strony społeczeństwa.
Obserwatorium Koronawirua prezentuje zaawansowane analizy sporządzane z zastosowaniem sztucznej inteligencji (AI) i w sposób wizualny prezentuje aktualności na temat COVID-19 oraz dane z mediów społecznościowych. Dostarcza również bieżące informacje na temat toczących się badań nad szczepionką, wraz z trendami dotyczącymi zachowań koronawirua. Obserwatorium Koronawirusa analizuje również oddziaływania koronawirusa w skali globalnej, a także z rozbiciem na poszczególne kraje. Prezentuje też wytyczne najważniejszych organizacji pozarządowych, władz odpowiedzialnych za ochronę zdrowia publicznego, czy stowarzyszeń naukowych.
– Chcemy, by Obserwatorium Koronawirusa stało się jednym z kluczowych narzędzi do śledzenia aktualności na temat koronawirusa i pozwoliło ludziom być na bieżąco z najnowszą wiedzą dotyczącą postępów w wyścigu po nowe szczepionki i leki – powiedziała Nuala Murphy, prezes, Clinical Research Services, ICON plc. – Sprawienie by ludzie byli dobrze poinformowani na temat rozwoju tej globalnej pandemii jest kluczowe w chwili, kiedy podjęto tak wiele środków prewencyjnych mających wpływ na ich aktywność publiczną.
– ICON jest zdeterminowana by włączyć się w badania nad koronawirusem i nieprzerwanie, wspólnie z naszymi klientami, pracujemy nad rozwojem szczepionki, leków oraz testów. Jednocześnie nie zapomnieliśmy o tysiącach pacjentów, którzy wiążą nadzieje z ICON oraz naszymi klientami w zakresie rozwoju ratujących życie terapii przeciw szerokiej gamie innych chorób. Nasi badacze pracują bez przerwy, pomimo wyzwań związanych z COVID-19, i wykorzystujemy wszelkie dostępne narzędzia, by zminimalizować ryzyko zakłóceń prac.
W lutym ICON zmobilizowała zasoby w kierunku globalnego zagrożenia związanego z COVID-19, wykorzystując swoje zdolności prowadzenia badań w systemie home-based, w celu minimalizacji ryzyka zakażeń. Firma zapewnia obecnie monitorowanie oraz nadzór nad bezpieczeństwem kilku badań klinicznych prowadzonych we wskazaniu COVID-19, zarówno dla sektora prywatnego, jak i rządowego. Prace obejmują badania nad szczepionkami profilaktycznymi u zdrowych uczestników, a także badania nad terapiami przeciwwirusowymi u pacjentów z potwierdzonym zakażeniem koronawirusem. ICON w ciągu ostatnich pięciu lat zaangażowana była w 246 badań nad szczepionkami na całym świecie, w tym w ponad 40 badań dotyczących wirusowych zakażeń układu oddechowego.
Obserwatorium Koronawirusa na stronie: https://iconplc.com/services/clinical-research-services/covid-19/coronavirus/


Prezes Agencji Badań Medycznych dr n. med. Radosław Sierpiński zatwierdził listę rankingową zawierającą wyniki pierwszego konkursu ABM na wsparcie niekomercyjnych badań klinicznych.
Pod koniec września ubiegłego roku, Agencja Badań Medycznych ogłosiła pierwszy konkurs na realizacje projektów badawczo-naukowych dotyczących niekomercyjnych badań klinicznych, na którego cel zaplanowano 100 mln zł dofinansowania. Ogłoszony przez ABM konkurs to dotychczas pierwsze tak duże wsparcie dla niekomercyjnych badań klinicznych w skali całej Europy Środkowo-Wschodniej.
Do Agencji w terminie konkursowym wpłynęło 78 wniosków o łącznej wartości blisko 1,5 mld zł. Średnia wartość projektu wyniosła około 17 547 374 zł. Największą liczbę wniosków złożono w obszarze onkologii oraz kardiologii.
Do oceny merytorycznej zostało skierowanych 77 wniosków z obszarów: pediatrii, neonatologii, neurologii, hematologii, radioterapii, onkologii oraz kardiologii. Całkowita wartość budżetów projektów skierowanych do oceny merytorycznej wynosiła 1 293 791 816,28 zł.
– Tak duże zainteresowanie konkursem i blisko piętnastokrotne przekroczenie alokowanego budżetu pokazuje silny mandat i potrzebę powstania Agencji Badań Medycznych – podsumowuje dr n. med. Radosław Sierpiński – Prezes Agencji.
Mając na uwadze ogromne zapotrzebowanie na podejmowanie niekomercyjnych badań klinicznych oraz wysoki poziom naukowy konkursu Prezes Agencji Badań Medycznych podjął decyzję o podniesieniu pierwotnej alokacji konkursu ze 100 mln zł do 462 997 769,97 zł.
Zwiększenie alokacji do wskazanego poziomu pozwoli na sfinansowanie 28 projektów z następujących obszarów: kardiologii (10 projektów), onkologii (8 projektów), pediatrii (5 projektów), neurologii (3 projekty) oraz hematologii (2 projekty).
Dokładnie rok od powołania Agencji Badań Medycznych prezentujemy listę laureatów pierwszego konkursu na wsparcie niekomercyjnych badań klinicznych. Wierzę, że dofinansowanie na poziomie blisko pół miliarda złotych pozwoli na dynamiczny rozwój tego sektora w naszym kraju – podkreśla Prezes ABM Radosław Sierpiński.
Pełna lista beneficjentów konkursu dostępna jest na stronie Agencji Badań Medycznych: https://abm.gov.pl/pl/aktualnosci/292,Agencja-Badan-Medycznych-oglasza-wyniki-pierwszego-konkursu-na-wsparcie-niekomer.html


Komunikat Prezesa z dnia 24 marca 2020 r. w sprawie trybu składania dokumentacji do Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych.


AstraZeneca poinformowała, że dostarczy dziewięć milionów masek ochronnych dla pracowników służby zdrowia na całym świecie, którzy walczą z globalną pandemią choroby COVID-19. AstraZeneca nawiązała współpracę partnerską z inicjatywą COVID Action Platform Światowego Forum Ekonomicznego, utworzoną przy wsparciu Światowej Organizacji Zdrowia (WHO) w celu identyfikacji krajów o największych potrzebach. Krajem, do którego trafi pierwsza dostawa masek będą Włochy, a następnie kolejne kraje.
Niezależnie od wsparcia walki z pandemią poprzez dostawy masek, AstraZeneca przyspiesza prace nad zwiększeniem zdolności produkcyjnych testów diagnostycznych, które pozwolą badać większą liczbę osób. By być w stanie zapewnić stałe dostawy swoich leków pacjentom, AstraZeneca podda również testom swoich pracowników w fabrykach oraz w łańcuchach dostaw.
Zespoły działu badań i rozwoju (R&D) AstraZeneca pracują na przyspieszonych obrotach w kierunku identyfikacji przeciwciał monoklonalnych, które będzie można wprowadzić w etap badań klinicznych we wskazaniu prewencji COVID-19. Ponad 50 ekspertów z obszarów wirusologii, immunologii, pulmonologii i inżynierii białek czyni starania w kierunku stworzenia terapii pozwalającej minimalizować wpływ choroby na społeczności całego świata.
Pascal Soriot, Chief Executive Officer w AstraZeneca, powiedział: – Nasze myśli są z wszystkimi cierpiącymi z powodu tej globalnej pandemii oraz z dzielnymi pracownikami służby zdrowia, którzy o nich dbają. Jako firma priorytetowo potraktowaliśmy partnerską współpracę z władzami odpowiedzialnymi za ochronę zdrowia w wielu krajach, a także z innymi organizacjami, dzieląc się wiedzą i ekspertyzą naukową. Postanowiliśmy przekazać maski ochronne, przyspieszając jednocześnie prace nad testami diagnostycznymi oraz terapią przeciw COVID-19.
Przedmiotowe dziewięć milionów masek zostanie wyprodukowanych oraz dystrybuowanych z Chin, gdzie AstraZeneca posiada silną pozycję rynkową oraz ścisłe relacje z tamtejszym systemem opieki zdrowotnej oraz z sektorem produkcyjnym.
Od chwili wybuchu pandemii COVID-19, AstraZeneca już wielokrotnie przekazywała środki finansowe, leki oraz środki ochrony osobistej na rzecz organizacji ochrony zdrowia w Chinach i w wielu innych krajach.


W odpowiedzi na obecne zagrożenie epidemiologiczne spowodowane pojawieniem się wirusa SARS-CoV-2, Prezes Agencji Badań Medycznych w porozumieniu z Ministrem Zdrowia podjął decyzję o rozpoczęciu przez ABM badania własnego pn. „Badania nad szczepionką przeciwko wirusowi SARS-CoV-2 oraz wsparcie prac badawczych nad poszukiwaniem skutecznej terapii”, które realizowane będzie w partnerstwie z polskimi i międzynarodowymi ośrodkami.
– Podejmujemy wyzwanie wobec zagrożenia epidemiologicznego naszych obywateli poszukując skutecznej drogi w walce z CoV-2. Wierzę, że poza zabezpieczeniem sanitarno-epidemiologicznym Polaków, które jest realizowane przez Rząd na najwyższym poziomie, musimy aktywnie włączyć się w światowe prace nad znalezieniem skutecznej metody prewencji i terapii tej choroby. Liczę, że dzięki współpracy ze stroną amerykańską oraz wiodącymi grupami badawczymi ze świata uda nam się przekazać wkład w te tak ważne i potrzebne dziś rozwiązania. – podkreśla dr n. med. Radosław Sierpiński – Prezes Agencji Badań Medycznych.
Obecnie toczą się rozmowy dotyczące kształtu i możliwości współpracy między innymi z amerykańskim National Institutes of Health (NIH) i dr. Anthony’m S. Fauci – Dyrektorem Instytutu Chorób Zakaźnych w Waszyngtonie. ABM prowadzi także zaawansowane rozmowy z międzynarodowymi Uniwersytetami w Europie, a otwarcie na współpracę zadeklarowała również Ambasada Chin oraz badacze z Niemiec i Kanady.
Agencja Badań Medycznych w ramach realizacji projektu, wybrała do współpracy trzy polskie ośrodki – Sieć Badawczą Łukasiewicz – Instytut Biotechnologii i Antybiotyków wraz z zespołem prof. Marcina Drąga z Politechniki Wrocławskiej, Narodowe Centrum Onkologii w konsorcjum z Instytutem Biochemii i Biofizyki PAN i Warszawskim Uniwersytetem Medycznym oraz Uniwersytet Medyczny we Wrocławiu.
Jedną z koncepcji przygotowanych w ramach projektu, jest propozycja realizowana przez Narodowy Instytutu Onkologii i Instytut Biochemii i Biofizyki PAN, który we współpracy z innymi naukowcami planuje zastosować nowatorską technologię łączącą wykorzystanie bakteriofagów i nanoprzeciwciał do opracowania terapii przeciwko zakażeniom wirusem SARS-CoV-2.
– W naszym projekcie chcemy wykorzystać nanoprzeciwciało, które umieszczone zostanie na główce bakteriofaga. To nanoprzeciwciało będzie w stanie rozpoznać wirus SARS-CoV-2 i uniemożliwi mu wniknięcie do komórek ludzkich. Bakteriofagi są wykorzystywane w terapii od dziesięcioleci i są bezpieczne dla człowieka. Natomiast nanoprzeciwciała są od niedawna testowane jako potencjalne leki. Dotychczas nikt jeszcze nie wykorzystał połączenia bakteriofag-nanoprzeciwciało do walki z wirusami ludzkimi. Jesteśmy pionierami. – podkreśla lider projektu prof. Jan Walewski, dyrektor NIO-PIB.
Polscy naukowcy poszukają również skutecznych terapii wśród znanych leków poprzez intensyfikację prac nad inhibitorami proteazy SARS-CoV-2 Mpro. Celem badania jest zahamowanie działania enzymu, co pozwoli na zablokowanie rozprzestrzeniania się wirusa. Za realizację konceptu odpowiedzialni są naukowcy z Sieci Badawczej Łukasiewicz – Instytut Biotechnologii i Antybiotyków wraz z zespołem prof. Marcina Drąga z Politechniki Wrocławskiej. Prace prowadzone są we współpracy z grupą prof. Rolfa Hilgenfelda z Lübeck University w Niemczech, który miał olbrzymi wpływ na wygaszenie poprzedniej epidemii SARS (w 2002/2003 r.).
Uniwersytet Medyczny we Wrocławiu pod kierownictwem prof. Ewy Jankowskiej poprowadzi natomiast prace nad zastosowaniem chlorochininy (lek antymalaryczny) u chorych z potwierdzoną infekcją COVID-19 na wczesnym etapie choroby z łagodnymi objawami, aby zapobiec ciężkim powikłaniom płucnym.
Jak podsumowuje Prezes Agencji dr Radosław Sierpiński – Jestem przekonany, że wybrane przez nas koncepty to innowacyjne i ważne projekty o dużym potencjale naukowym, mogące przyczynić się do opracowania szczepionki lub skutecznych metod terapii koronawirusa. Wierzę, że wspólne działania podjęte przez Agencję Badań Medycznych i wybitnych badaczy przyniosą oczekiwane przez wszystkich efekty.
Kwotą inicjacyjną przeznaczoną na projekt jest 5 mln zł, jednak jeśli zajdzie taka potrzeba, środki te będą dynamicznie zwiększane. – deklaruje Prezes ABM.
© 2022 Wszystkie prawa zastrzeżone